塩酸・硫酸・アンモニア・塩化銅の希釈の方法(希釈の基本を押さえよう!~薬品の正しい使い方と授業準備~)
サイエンストレーナーの桑子研です。毎日が実験。

理科室で薬品を扱うとき、“安全に・正確に・効率よく”実験を行うためには、希釈の基本知識が欠かせません。今回は、薬品を使ううえで押さえておきたい希釈の方法・安全面と実際の実験での濃度の目安を、先生方向けにまとめてみました。もともと自分で気になって調べてまとめたものですが、「きちんと準備していた」ことは安心材料になりますし、失敗のない準備が授業の質を支えてくれます。この記事を読めば、よく使う薬品の希釈の考え方がばっちり整理できます。
例えば浜島書店の理科便覧243ページなどを見ると、希釈方法について作り方等がまとめて載っています。水酸化ナトリウムの電気分解で使うときの濃度は5%でもOK。塩酸の電気分解で使う塩酸の濃度も5%でOKだということがわかります。このページでは、より詳しく・現場の先生向けに実際に溶液の作り方についてまとめています。実際の質量パーセント濃度からモル濃度への変換方法などの計算方法については、別記事にまとめました。こちらをご覧ください。
塩酸の希釈について
中学校の理科実験で使うことが多い塩酸は、濃塩酸を一気に薄めて使うといいそうです。10%の塩酸を作るには、体積比で濃塩酸1に対して水を⒊2加えるとできます。たとえば500㎤入りの濃塩酸を全て10%にするには、1600㎤の水で薄めるといいので、3リットルのポリエチレンの容器(amazon)に薄めて保管すると便利です。

|
|
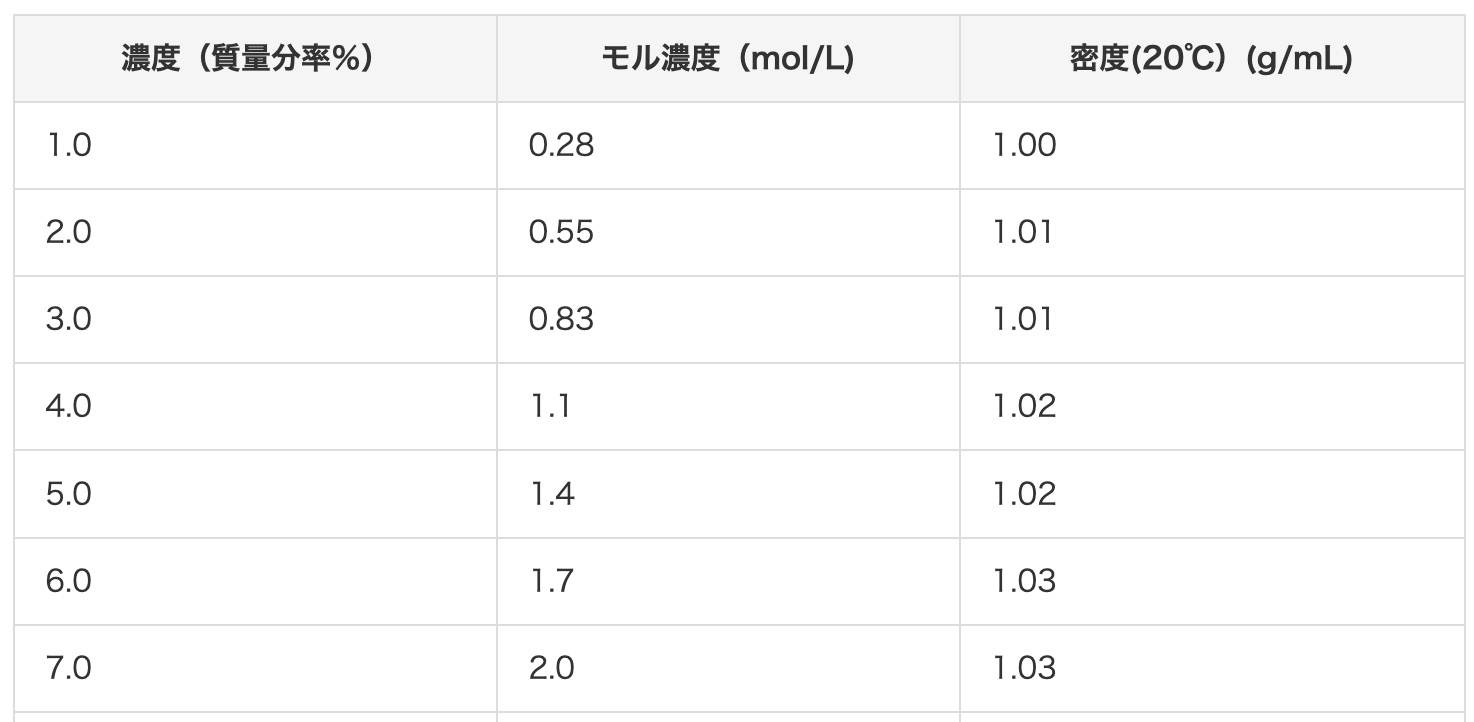
また希釈の方法にいては、こちらを御覧ください。
心配な方は、式でも確かめておきましょう。
例えば濃塩酸は12mol/Lで、密度は1.18g/mLなので、例えば濃塩酸1L(1000mL)の溶液の質量は、
1.18×1000=1180g
また、溶質の質量は、分子量を36.5とすると、
12×36.5=438g
よって濃塩酸の質量%濃度は、
438/1180=37.1%
です。この濃度を水を加えて10%にするためには、加える水の量をx[g]とすると、
438/(1180+x)=10/100
x=3200g
となります。よって塩酸1Lに対して、水3.2L加えれば、濃度が10%の塩酸になることになります。塩酸が500mLなら、その半分なので、1.6Lとなります。
注意点
塩酸を希釈するとき,水に塩酸を加えるようにすることです。酸やアルカリに水を加える(×)と溶解による発熱で,加えた水が飛び散る場合があるためです。塩酸や硫酸の希釈の方法などについて参考になるサイトをまとめておきました。なお濃塩酸の濃度と濃硫酸の濃度の違いは、溶解度の違いによるとのことです。

濃度9パーセントの場合は、規定度Nおよそ2.6(2.6mol/L)
濃度4パーセントの場合は、規定度Nおよそ1(1mol/L)
参考:http://www.keins.city.kawasaki.jp/9/ke9004/benrihp060821/2020.benrichou.ensan.pdf
濃塩酸の濃度は12mol/Lである。したがって,1mol/Lの濃度にするには12倍に希釈する必要がある。総量が12でその中に塩酸が1ということで,塩酸1:水11の割合で混ぜるとよい。
※注意 希釈するとき,酸やアルカリに水を加えると溶解による発熱で,加えた水が飛び散って危険なことが起こりうる。希釈するときは必ず,水に酸やアルカリを加えるようにする。
【塩酸の場合】
・ 濃塩酸の濃度は12mol/Lである。したがって,1mol/Lの濃度にするには12倍に希釈する必要がある。総量が12でその中に塩酸が1ということで,塩酸1:水11の割合で混ぜるとよい。
(例)水110mLに塩酸10mLを入れる。
※注意 希釈するとき,酸やアルカリに水を加えると溶解による発熱で,加えた水が飛び散って危険なことが起こりうる。希釈するときは必ず,水に酸やアルカリを加えるようにする。
【アンモニア水の場合】
・ 濃アンモニア水は14mol/Lである。したがって,1mol/Lのアンモニア水を作るときは,濃アンモニア水1:水13の割合で混ぜるとよい。
※ 溶質が液体であればモル濃度,固体の場合は分子量が分かると目的とする濃度の水溶液を作ることができる。参考 http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
水酸化ナトリウムの希釈について
【水酸化ナトリウムの場合】
・ 水酸化ナトリウムの1モルは40gである。したがって,40gの水酸化ナトリウムを水に溶かし1Lにした時が1mol/Lである。
1mol/L(4%)の水酸化ナトリウム水溶液100mLを作るときは,4gの水酸化ナトリウムを水に溶かし100mLにする。
※ 水酸化ナトリウムは水に溶かす際に発熱反応を起こす。そこで,少量の水で溶かし,水温を上げてから残りを溶かすようにすると簡単である。参考 http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
◆多量の溶液(約500mL以上)を作る場合
1 作成する容量がはかれるメスシリンダー(例えば,500mL作成するなら500mLまたは1000mL)で蒸留水をはかりとり,半分は大きめのビーカーAに移し,残りはメスシリンダーに残しておきます.
2 天秤を用いて別のビーカーBに水酸化ナトリウムをはかりとり,すぐに1のビーカーAの蒸留水に加えてよくかき混ぜます.2のビーカーBの底に付着した水酸化ナトリウムは,メスシリンダーの蒸留水を加えて溶かした後で1のビーカーAに移します.
3 必要ならば,試薬ビンに移して保管します.試薬名,濃度,作成日,作成者などを書いたラベルを付けましょう.◆少量の溶液(約500mL未満)を作る場合
1 メスシリンダー(例えば,100mL作成するなら100mLまたは200mL)で蒸留水をはかりとります.
2 天秤を用いてビーカーに水酸化ナトリウムをはかりとり,すぐに1ではかりとった蒸留水を加えてよくかき混ぜます.
3 必要ならば,試薬ビンに移して保管します.試薬名,濃度,作成日,作成者などを書いたラベルを付けましょう.
塩化銅の電気分解につかうときの濃度調整について
電気分解で使う塩化銅の溶液の調整については、塩化銅を13gとって、蒸留水を入れて、300gの水溶液で行いました。およそ3%の塩化銅水溶液です。詳しくはこちらをご覧ください。薄い溶液ですが実験は十分にできます。
ダニエル電池の濃度調整について
#硫酸亜鉛 水溶液 5パーセント 9.8gに水100g #硫酸銅 水溶液 約17パーセント 35.7gに水100g
こちらに詳しくはまとめました。
その他の参考になるサイト
*酸性・アルカリ性を調べる実験 この実験ではリトマス紙の色が変わればいいので,通常約 0.3 ~1 mol/L 程度で 十分です。0.3 mol/L ならば,濃塩酸:水= 1:39 *金属を入れて水素を発生させる実験 金属を溶かす実験では,ある程度の濃度が必要です。約3 mol/L に薄めましょう。 濃塩酸:水=1:3
参考 https://www.ice.or.jp/nc/?action=common_download_main&upload_id=1169
◆おわりに
「ちょっと濃すぎたかも…」「もっと薄めるべきだった?」という不安は、事前の知識と準備で解消できます。希釈の方法をきちんと押さえておけば、実験時の安全性も高まり、生徒に正しい科学の姿勢を伝えることにもつながります。薬品の扱いには十分注意しながら、理科の楽しさと奥深さを伝えていきましょう!
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!
・運営者・桑子研についてはこちら
・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら
・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20

テレビ番組等・科学監修等のお知らせ
- 2/9日(月)まで配信中 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 一般社団法人 日本理科教育学会 オンライン全国大会2026にて、「慣性の法則の概念形成を目指した探究的な学びの実践」について発表予定です。
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)