エコで簡単、後片付けも楽々! 重ねるだけの「ハンバーガー式ダニエル電池」実験
サイエンストレーナーの桑子研です。毎日が実験。
「理科の実験」と聞くと、たくさんの試験管や、後片付けが大変な液体を想像しませんか?特に電池の仕組みを学ぶ「ダニエル電池」は、準備も廃液の処理もちょっぴり手間がかかるのが悩みの種でした。ところが、そんな常識を覆す面白い実験があるんです。その名も「ハンバーガー式ダニエル電池」!
名前は美味しそうですが、実はこれ、環境に優しくて準備も簡単な、驚きのエコ実験なんです。今回は、まるでサンドイッチを作るように電池を組み立てる、ワクワクする実験ストーリーをお届けします。通常のダニエル電池について詳しく知りたい方は、こちらの記事もぜひご覧ください。
美味しそうな名前の秘密!材料と準備
ハンバーガー式ダニエル電池の最大の特徴は、液体をドバドバ使わず、ろ紙やキッチンペーパーに溶液を染み込ませて重ねる点にあります。これによって廃液が劇的に減り、片付けが驚くほど楽になります。この電池の心臓部となるのが「セロハン」です。通常のダニエル電池では「素焼き板」や「塩橋」という特別な道具を使いますが、今回は100円ショップのカラーセロハンが大活躍!これが異なる液体を仕切りつつ、イオンだけを通す「関所」の役割を果たしてくれます。

さらに驚くことに、セロハンがなくても「コピー用紙」で代用できるという情報も!身近なもので科学ができるなんて、ワクワクしますね。
【準備するもの】
- 硫酸亜鉛水溶液:約5%
- 硫酸銅水溶液:約17%(美しい青色の液体です)
- ポリスポイト、シャーレ、亜鉛板、銅板
- ろ紙(またはキッチンペーパー)、セロハン、テスター、電子メロディーなど

これだけの材料で、立派な電池が作れます!
実験開始!金属のサンドイッチを作ろう
それでは、ハンバーガーを組み立てるように電池を作っていきましょう。順番を間違えると電気が流れないので、ここが腕の見せどころです!手順1:ろ紙を液体にひたすシャーレの上で、ろ紙に硫酸銅水溶液と硫酸亜鉛水溶液をそれぞれ染み込ませます。

キッチンペーパーでも代用可能です。その場合はピペットにとって適量をかけましょう。
手順2:順番に重ねる机を汚さないようにティッシュを敷き、下から順番に重ねていきます。「銅板 → 硫酸銅ろ紙 → セロハン → 硫酸亜鉛ろ紙 → 亜鉛板」この層が、電子を動かす「力」を生み出します。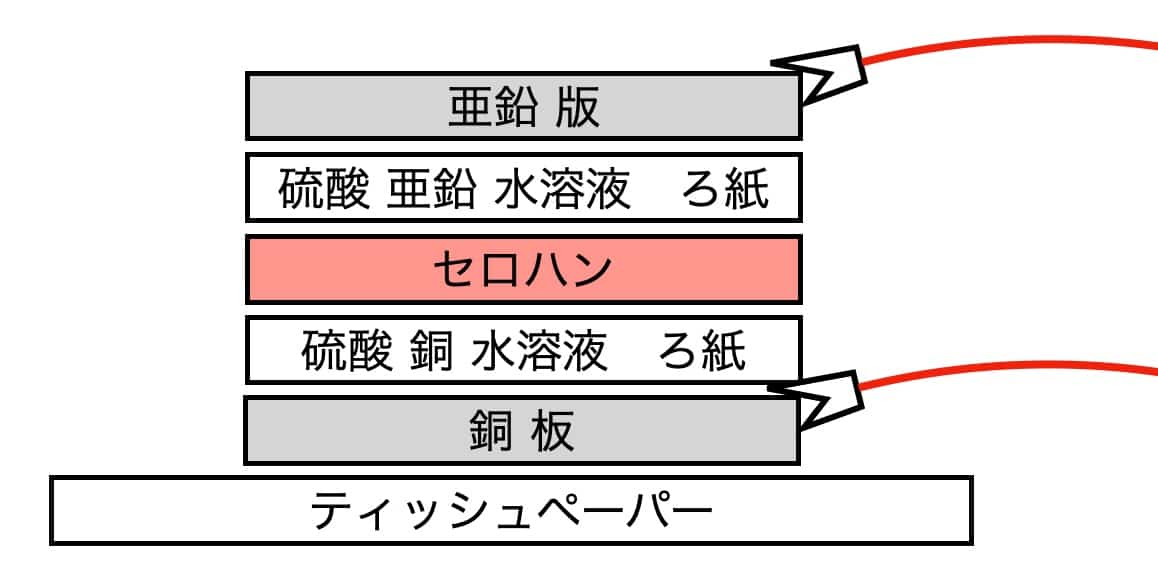 最後に亜鉛板を乗せて、完成!銅板と亜鉛板が直接触れて「ショート」しないように気をつけてくださいね。
最後に亜鉛板を乗せて、完成!銅板と亜鉛板が直接触れて「ショート」しないように気をつけてくださいね。 手順3:電気が流れるかチェック!ワニ口クリップで繋いで、電子メロディーを鳴らしたり、テスターで電圧を測ってみましょう。
手順3:電気が流れるかチェック!ワニ口クリップで繋いで、電子メロディーを鳴らしたり、テスターで電圧を測ってみましょう。

電圧を測ると、約1Vのパワーが確認できました!
なぜ電気が流れるの?金属たちの「溶けたい度」勝負
さて、なぜこんなサンドイッチから電気が生まれるのでしょうか?そこには、金属たちの「性格の差」が深く関わっています。電池の正体は、実は「電子」という小さな粒の移動です。ダニエル電池の中では、金属たちの「どれだけイオンになって水に溶けたいか」という勝負が行われています。(これをイオン化傾向と呼びます)
- 亜鉛 (Zn):「僕は電子を捨ててでも、早く水に溶けたいんだ!」という積極派。
- 銅 (Cu):「僕は今のままでいいよ。むしろ水の中の銅イオンを助けて、金属に戻してあげたいな」という慎重派。
この性格の差が、電気の流れを生みます。
1.マイナス極(亜鉛) 亜鉛が電子(e^-)を2つ放り出して、亜鉛イオン(Zn^{2+})となり、ろ紙の中へ溶け出します。
\[Zn \rightarrow Zn^{2+} + 2e^-\]
放り出された電子たちは、導線を通って銅板の方へ一斉に走り出します。これこそが電流の正体です!
2.プラス極(銅) 銅板にたどり着いた電子を、ろ紙の中にいた銅イオン(Cu^{2+})が「待ってました!」と受け取ります。
\[Cu^{2+} + 2e^- \rightarrow Cu\]
電子をもらった銅イオンは、金属の「銅」に戻り、板にピタッと付着します。実験後、ろ紙を剥がしてみると、銅板側のろ紙が赤っぽくなっているのが分かります。これは新しい銅が析出した証拠。逆に亜鉛板側のろ紙が茶色くなっているのは、セロハンを通り抜けた銅イオンと反応してしまったのかもしれません。こうした「想定外」の観察も、科学の面白いところですね!

ハンバーガー式ダニエル電池は、準備が簡単なだけでなく、「何が起きているか」を自分の手で組み立てながら学べる素晴らしい実験です。デモンストレーション用の大きな装置で全体を理解し、このハンバーガー式で実際に自分の手で発電させてみる。この2つのステップを組み合わせれば、ダニエル電池の仕組みがより深く、実感を持って理解できるはずです。身近な材料で、地球に優しく、そして楽しく。あなたも「自分だけの電池」を作ってみませんか?
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!・運営者・桑子研についてはこちら・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



