電気はどこへ消えた?中和反応が描く「感動のV字グラフ」の正体を追え!(水酸化バリウムと硫酸を使った中和の実験)
サイエンストレーナーの桑子研です。毎日が実験。
今回は、理科の実験の中でも特あにドラマチックな変化が楽しめる「水酸化バリウムと硫酸の中和反応」をご紹介します。この実験、実はただの化学反応ではありません。反応によって溶液中のイオンが姿を消していく様子が、電流計の針の動きとしてハッキリ現れるのです。そして、そのデータをグラフにすると驚くほど美しいV字型のカーブを描きます。科学の楽しさがぎゅっと詰まったこの実験、準備のコツから感動の結末まで、詳しく解説していきます!
事前準備:成功のカギは「上澄み液」にあり!
まずは準備から始めましょう。正確な準備は、安全で確実な実験への第一歩です。
1. 水酸化バリウム水溶液の作り方
授業日が決まったら、水にたっぷりの水酸化バリウムを溶かして、数日間そっと置いておきます。使うのは、その透き通った上澄み液です。 水酸化バリウムは強アルカリ性なので、必ず保護眼鏡を着用してくださいね。空気中の二酸化炭素と反応して白い膜(炭酸バリウム)ができやすいため、作り置きはせず、実験のたびに準備します。ビーカーにはラップをして保存しましょう。

分量の目安(4クラス分): 水220mLに対して、水酸化バリウム8水和物を約10g加えると、飽和水溶液が作れます。例えば8人班の場合は、5mL×8班=40mLあれば良いので、4クラスとすれば、160mLあれば足ります(多めの計算です)。

左が作ったばかり、みぎが作ってから1週間くらいおいたもの。透明になって上に膜が貼ります。
2. 硫酸の調整(希釈のルール!)
次に硫酸を用意します。ここで絶対に守らなければならない鉄則があります。それは、「絶対に濃硫酸に水を加えてはいけない」ということ。激しく熱が発生して液が飛び散り、非常に危険です。必ず「水に濃硫酸を少しずつ加える」順番を守ってください。
希釈の目安(4クラス分): 水51mLに濃硫酸3mLを慎重に入れ、これを10倍に薄めて合計540mL(約0.1mol/L)にします。
試験管に15mLほど入れ、ピペットと一緒にセットしておくと、生徒たちが計り取りやすくなります。また水酸化バリウム水溶液5mLをビーカーに入れて班の数用意をしておきます。

準備が整ったら、いよいよ実験開始です。

回路はこんな感じです。ミニ電源装置Petit-X(プチエックス)が活躍しました。普通の電源装置でももちろんOK。
スイッチON!電圧を設定
電源装置をつなぎ、電圧を5Vに設定して電気を流します。この時点ではイオンがたくさんあるので、電流はしっかり流れます。

電流系はプチメーターを使いました。便利です。
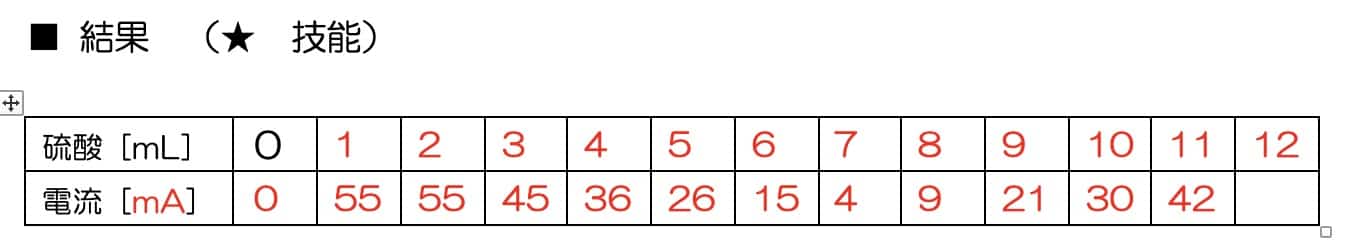
硫酸を1mLずつ滴下
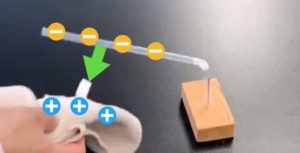
ここからが本番です。硫酸を1mLずつ加えて、そのたびに電流計の数値を読み取っていきましょう。

感動のV字グラフ!なぜ電気は消えたのか?
実験データをグラフにすると、驚きの結果が待っています。
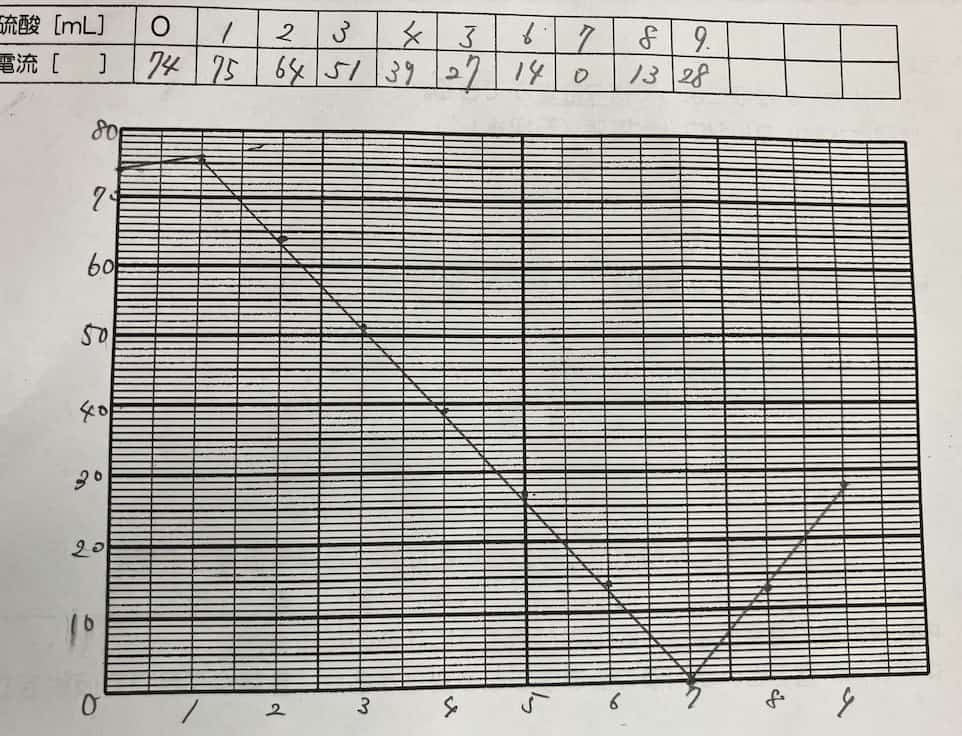
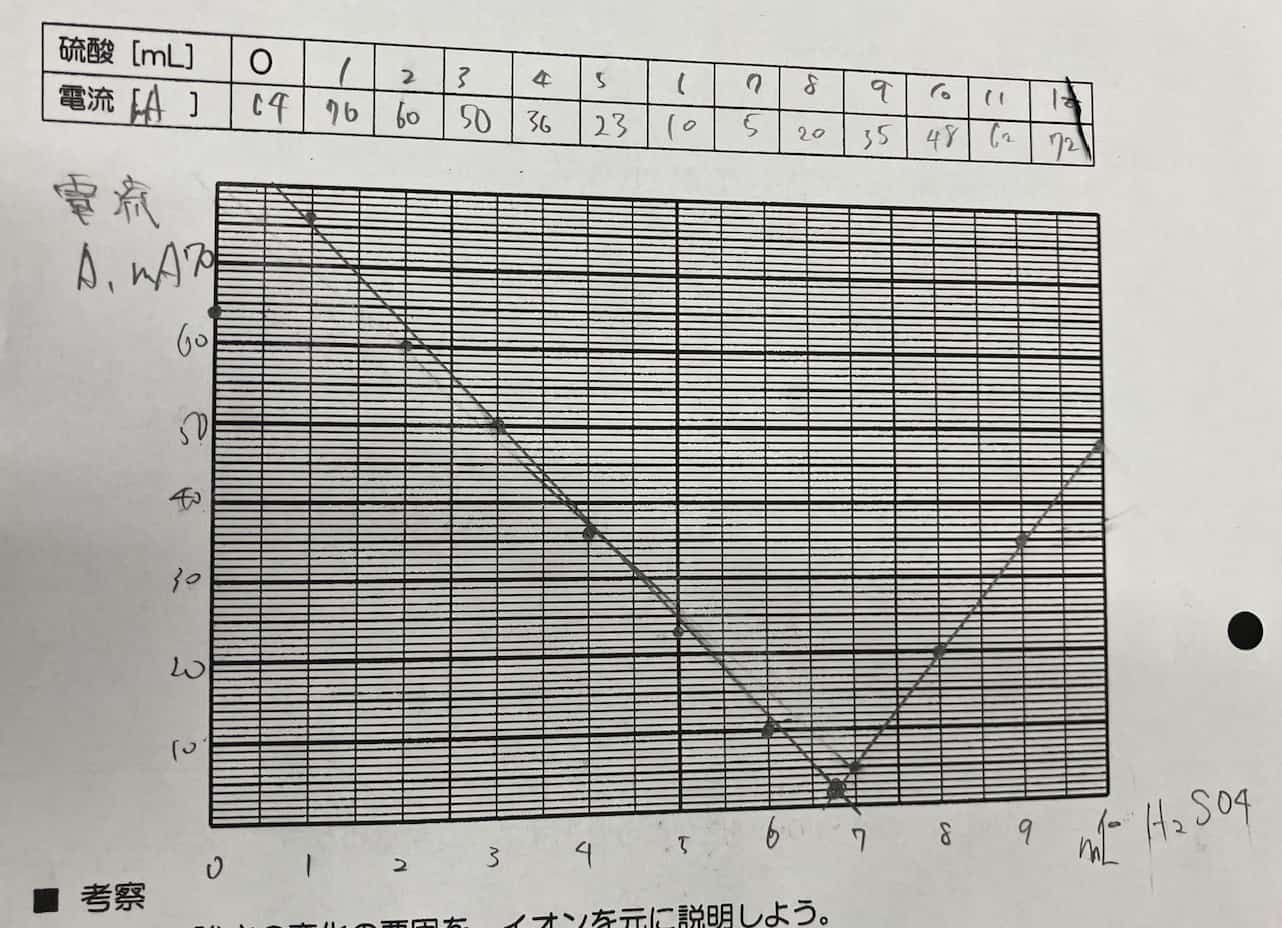
硫酸を加えるにつれて電流はどんどん減っていき、ある一点でほぼゼロになります。そしてそこを過ぎると、再び電流が増え始めるのです!
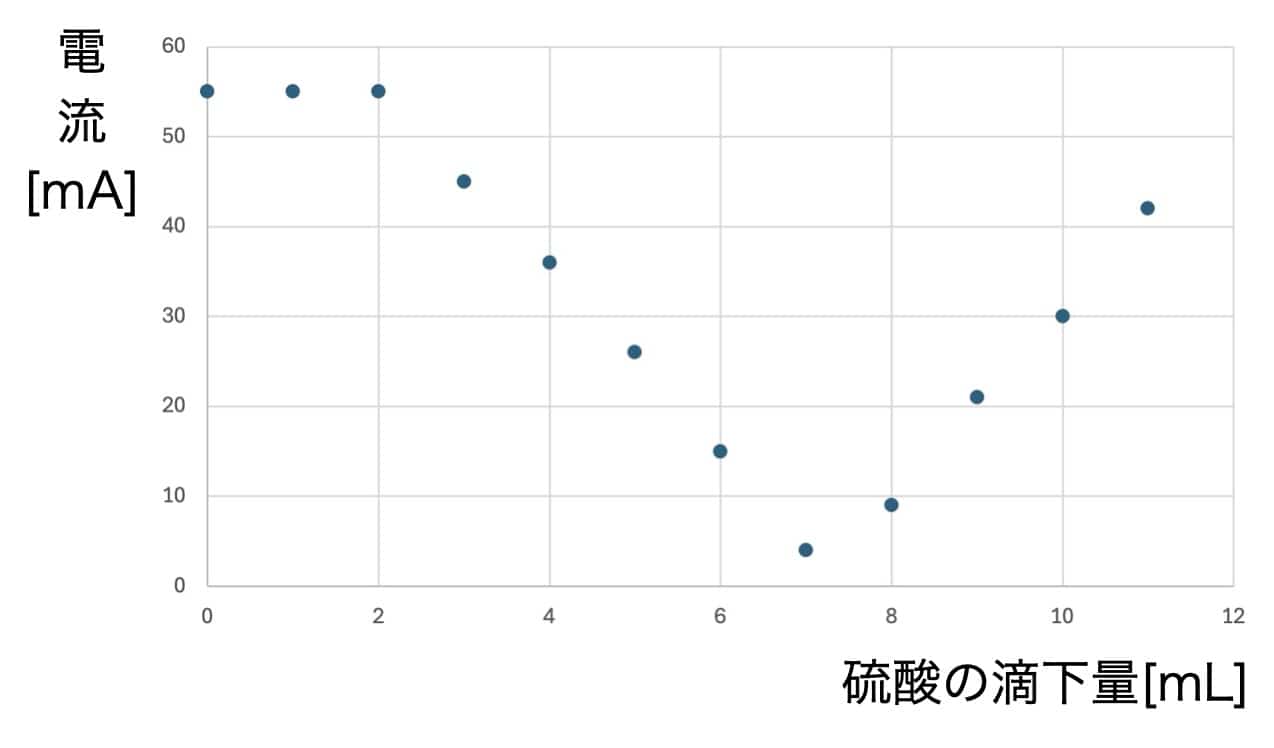
なぜ、このような見事なV字型になるのでしょうか? その秘密は、反応によって生まれる「難溶性(水に溶けにくい)の塩(えん)」にあります。水酸化バリウムと硫酸が出会うと、水に溶けにくい「硫酸バリウム」という白い沈殿ができます。
水溶液中で電気を運んでいたイオンたちが、次々と合体して固体の粒(沈殿)になって沈んでしまうため、電気の運び手(イオン)がいなくなり、電流が流れなくなるのです。さらに硫酸を足すと、今度は余分な硫酸のイオンが増えるため、再び電流が流れ始めます。なお塩酸と水酸化ナトリウムの場合にできる塩は塩化ナトリウムです。塩化ナトリウムが水に溶けてしまうので、こういう反応は起こりません。つまり難容性というのがこの実験のポイントになるわけですね。
実験を終えて:理科の楽しさは「変化」の中に
電流がゼロに向かって刻々と減っていく様子は、何度見ても面白い傾向です。ただ教科書で「イオンが減る」と教わるよりも、自分の手で電流計の針が止まる瞬間を目撃することで、「目に見えないミクロの世界で何かが起きている!」という実感を持つことができます。化学反応の美しさを視覚とデータで楽しめるこの実験。ぜひ皆さんも、そのV字の谷間に隠された科学のドラマを体験してみてくださいね!
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!
・科学のネタ帳の内容が本になりました。詳しくはこちら
・運営者の桑子研についてはこちら
・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら
・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20

テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日 科学監修をした番組が放送予定です。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。