カリウムK・カルシウムCaはなぜM殻に入っていかないのか?
サイエンストレーナーの桑子研です。このサイトで科学を一緒に楽しみましょう。
電子を収容するエネルギーの異なるそうを電子殻といいます。中学ではK殻、L殻、M殻などを学習します。これらの電子殻に収容できる電子の最大数は決まっていて、K2個、L8個、M18個、N32個です。これはあくまで最大収容数なので、これだけ収容できますよという数です。
ここで疑問が生じじますね。K2個、L8個、M8個(アルゴンまでいくと)入ると、K、CaはN殻1個、2個とに入っていくようになっています。なぜまだ収容できるM殻に入っていかないのでしょうか。そしてその後のスカンジウムやチタンは、NではなくM殻に入っていきます。
この謎についてですが、電子は原子核の周りを雲のように存在していることと関係があります(シュレディンガー方程式)。存在してる確率が高い空間を軌道といいます。その軌道にs軌道(2),p軌道(6),d軌道(10),f軌道(14)があります。ここでカッコ内は、それぞれの起動において電子を収容できる個数です。K殻、L殻、M殻、という電子殻は、これらの軌道の集合体のことをいいます。
次の表のように、K殻にはs軌道が1つ(1s軌道という)、L殻にはs1つp1つ(2s軌道、2p軌道という)、M殻にはs1つp1つd1つ(3s,3p,3d軌道という)となっています。
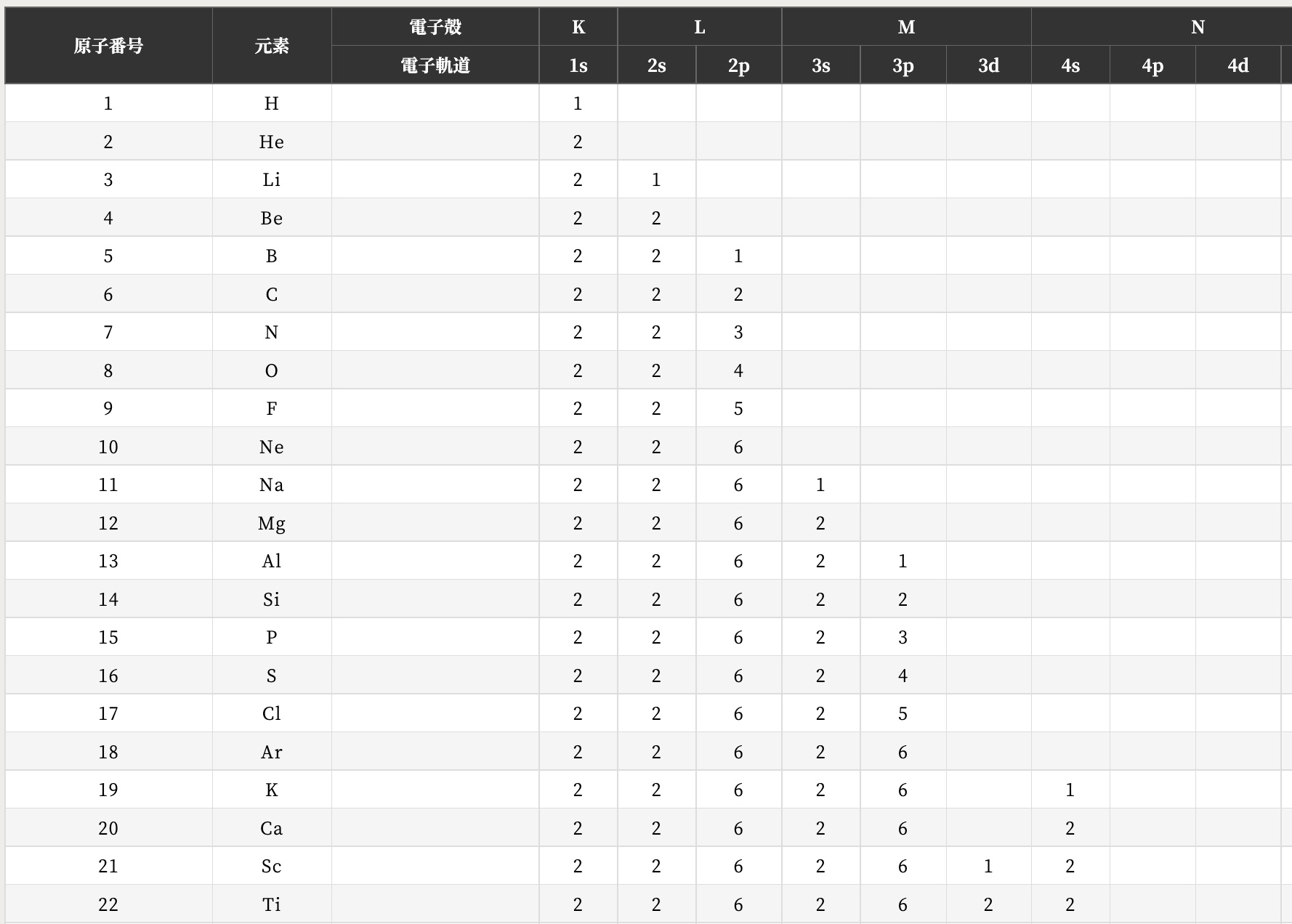
図は原子の電子配置表より引用
https://japanknowledge.com/contents/common/electronconfig.html
この表をみると、次にArの原子番号の次はカリウム、1sから3pまでは全て埋まってる。Arの状態は閉殻ではないが、とっても安定している(価電子が0)ので(この状態をオクテットといいます)、ここには入らず、次の起動のM殻に入る。Caも同様に4s軌道に電子が2つはいる。その後のスカンジウムやチタンについては、内側のM殻の軌道に電子が入っていきます。
こちらも参考になります → https://www.clearnotebooks.com/ja/questions/304550
物理基礎について本をかきました。
科学のタネを発信中!
ニュースレターを月1回配信しています。
[subscribe2]
登録はこちらから
3月のイチオシ実験!電気スライム

- みんなが大好きスライム作り。手作りだけ楽しんで終わりじゃもったいない・せっかくなので電気を流してみよう!電気回路の学習にもなります!
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。
- ティッシュでこするだけ!「動くストロー」で学ぶプラスとマイナスの静電気の科学
- 視点が変われば世界が変わる?回るカメラが捉えた「遠心力」の決定的瞬間
- 足場が逃げる!?「動く斜面」の物理学(固定されていない斜面を動く2物体の運動)
- アプリ不要!iPadとシール1枚で「物理の法則」を可視化する驚きの実験術
- わずかな衝撃で水が突然氷に!過冷却の実験と滝が凍る仕組み(氷の芸術「氷瀑」)
- なぜ?シャボン玉は静電気に「寄ってくる」のに、紙のチョウチョは「逃げる」のか?
- Scratchで作った「物理の見える化」運動の法則をシミュレーション(鉛直方向)
- 【科学監修】滝はどのようにして凍るのか?「チコちゃんに叱られる」(NHK)
- 物理の「なぜ?」を解決!摩擦とエネルギーの関係がひと目でわかるシミュレーション