水酸化バリウム水溶液に硫酸を加えたときの中和反応「化学の魅力を発見!電流が語る“難溶性の塩”の物語」
水酸化バリウムと硫酸の化学実験:V字グラフに感動!
こんにちは!科学を楽しく紹介するこのブログへようこそ。今日は、水酸化バリウムに硫酸を加えたときの電流の変化についてご紹介します。この実験では、反応によってイオンが減少していくという特徴を観察することができます。そして、驚くほど美しいV字型のグラフが得られるんです!これが科学の楽しさを存分に味わえる瞬間です。
事前準備:成功のカギはここにあり!
まずは、準備についてお話しします。正確な準備は、実験の成功に直結しますよ。
授業をやる前日などに、水に十分な量の水酸化バリウムを溶かして、数日間放置した上澄み液を使います。この溶液は強アルカリ性なので,保護眼鏡を使用することが大切です。空気中の二酸化炭素を吸収すると炭酸バリウムの沈殿が生じてしまうので,実験のたびにつくるようにする必要があるとのことなので、次年度まで使えなそうですね。作ったらビーカーにラップをしておきましょう。
水酸化バリウムの使用量は1クラス、5mL(1班)×10班=50mL 4クラスで、200mLあれば足りまるので、ちょっと多めに220mLとしました。
水酸化バリウムの溶解度は、水の温度によって異なりますが、例えば 20℃ の場合は3.9gくらいなので、水220mLに、多めにして水酸化バリウムを10gくらい加えると飽和水溶液を作ることができます。
次に硫酸の調整です。指導書には次のように書かれていました。
水17mLに濃硫酸1mLを加えると1 mol/Lとなる(18mLになる)。これを10倍に希釈すると0.1 mol/Lとなる(水を入れた時に180mLになるようにする)。絶対に濃硫酸に水を加えてはいけません。激しく発熱し、液が飛び散る恐れがあります。
実験では硫酸は少し多めにして次年度にもまわせるので、12mL×10班=120mL、4クラス分作ると、120m×4クラス=480mL くらいあればいいので、上の3倍として、水51mLに濃硫酸を3mL入れて、54mLにして、これを10倍に希釈をして540mLとしました。
実験方法:科学の美しい瞬間を捉える!
次は実験手順です。手順はシンプルですが、注意深く進めることが大切です。
1.水酸化バリウム水溶液の準備
•教員が用意した水酸化バリウムの上澄み液を5mLずつ、小型のビーカーに分けます。
2.電流の測定
•ビーカーに電極を挿し、5Vの直流電流を流します。
•その状態で、硫酸を1mLずつ加えてかき混ぜるたびに、電流を記録します。
3.注意点
•滴下する硫酸がビーカーの壁につかないよう注意。
•皮膚に液が付着した場合は、すぐに大量の水で洗い流してください。
結果:感動のV字グラフ!
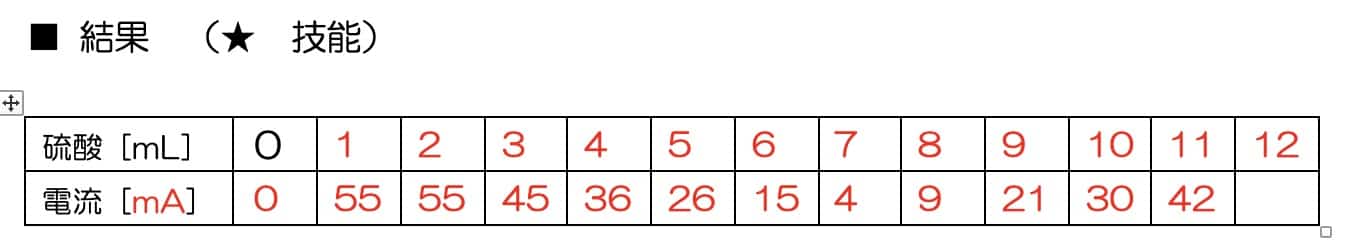
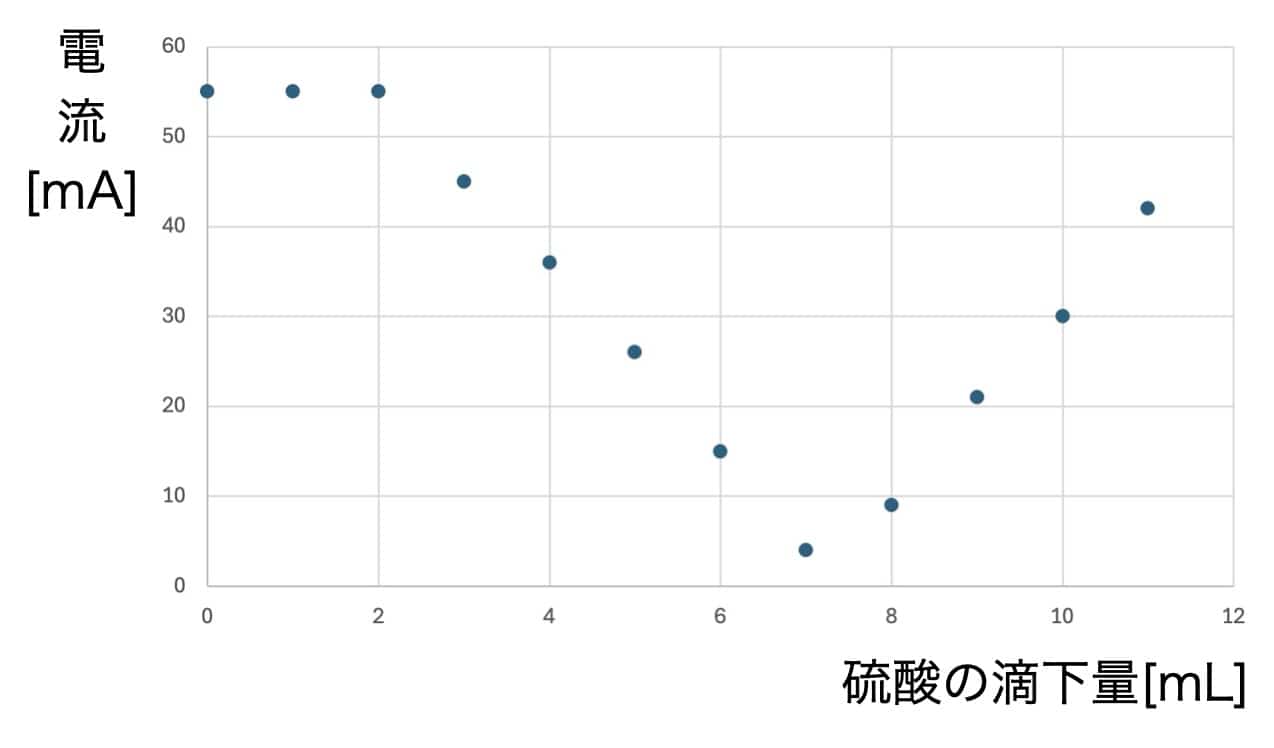
この実験で得られるデータをグラフにすると、硫酸を加えるごとに流れる電流が変化し、見事なV字型を描きます。この現象は、水酸化バリウムと硫酸が反応して生じる難溶性の塩(えん)が関係しています。反応が進むにつれて溶液中のイオンが減少するため、このようなグラフが得られるのです。
この実験は、化学反応の美しさを視覚的に楽しむことができる素晴らしい活動です。電流が減少し、再び増加する様子は、ただデータをとるだけでなく、「なぜこうなるのだろう?」という好奇心をかき立てます。こういった実験を通して「面白い!」と思える瞬間がきっとあるはずです。



