混ぜるだけで80℃!?手作りカイロで解き明かす「鉄がサビる熱」の科学!カイロのしくみを自作で学ぼう(発熱反応)
サイエンストレーナーの桑子研です。毎日が実験。
冬の寒い日、ポケットに忍ばせたカイロのじんわりとした温かさは、まさに天からの恵みのようですよね。でも、その袋の中で一体何が起きているのか、想像したことはありますか?
実は、あの小さな袋は「ポケットの中の化学工場」なんです。今回は、その工場の秘密を解き明かすべく、使い捨てカイロを自分で作り、化学の熱を“実感”する実験をご紹介します。

この実験、実際に授業で行うと生徒たちの目の輝きが変わります。「本当に温かくなってきた!」「見て、湯気が出てる!」そんな歓声が教室に響き渡るのです。目に見えない化学反応が、手で触れられる「熱」に変わる瞬間は、教科書だけでは味わえない最高の学びの体験です。
カイロ作りに挑戦!準備するものと手順
目的は、使い捨てカイロの仕組みを理解し、「酸化」という化学反応が熱を生み出すこと(発熱反応)を体験すること。さあ、準備を始めましょう!
■ 準備するもの(1班あたり)
- 鉄粉(300メッシュ):約4g(硫化水素の実験でも使ったものです)。今日の主役です!
- 活性炭:約2g。鉄の反応を助ける名サポーター。
- 食塩水(3%):3cm³。反応をスピードアップさせる魔法の水。
- 紙コップ:1個(小さめのもの)
- 温度計:1本
- ガラス棒:1本
- 薬包紙:適量

■ 実験の手順
① 鉄粉4gと活性炭2gを紙コップに入れ、ガラス棒で粉が均一になるようによく混ぜます。

② 食塩水3cm³を加え、すぐにガラス棒で手早くかき混ぜます。化学反応のスタートです!
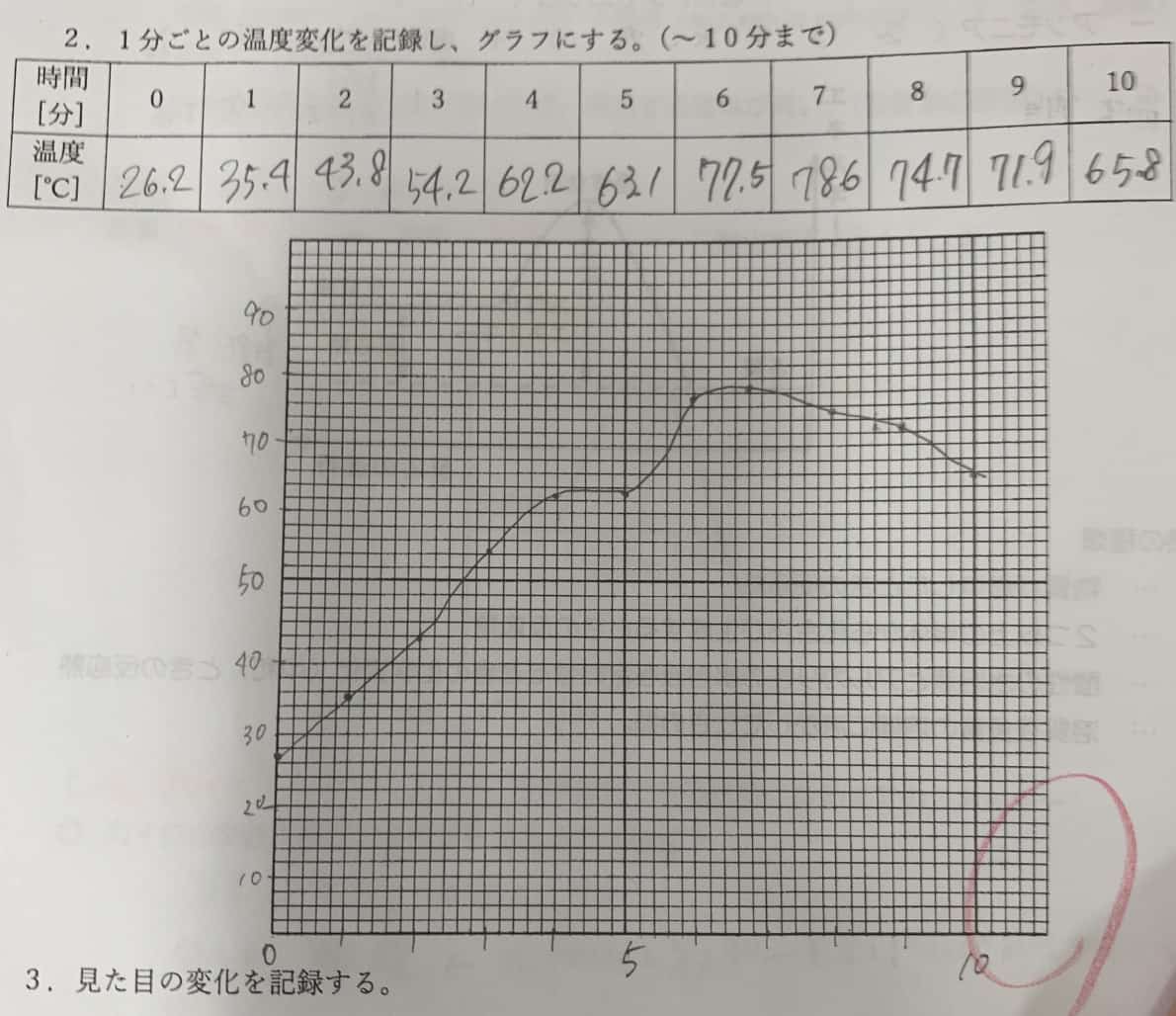
③ 温度計をさし、1分ごとに温度を記録。10分間測定して、変化をグラフにしてみましょう。
ポイント:時々かき混ぜて空気(酸素)を送り込むと、より温度が上がりやすくなります。

(ワードデータ)発熱反応のワークシート
混ぜるだけで80℃!?化学の“熱”を解き明かす
実験では、班によっては最高80℃近くまで温度が上昇し、湯気が出るほどの盛り上がりに!これは、紙コップの中で「鉄の酸化」、つまり「鉄が急速にサビる反応」が起きている証拠です。鉄は空気中の酸素と結びついてサビる時、熱を放出する性質があるのです。カイロの温かさの秘密は、この化学反応にありました。
4Fe + 3O₂ + 6H₂O ⟶ 4Fe(OH)₃ + 熱エネルギー
この化学式、難しく見えるかもしれませんが、カイロの中の「最強チーム」の活躍を描いた物語だと思ってみてください。
- 鉄粉 (Fe):【主役】酸素と結びついて熱を出す、エネルギーの源。
- 酸素 (O₂):【相棒】空気中からやってきて、鉄と反応します。
- 水 (H₂O) と 塩類:【サポーター】鉄と酸素の反応を猛スピードで進ませる触媒の役割を果たします。食塩水を入れた途端に温度が上がり始めるのは彼らのおかげです。
- 水酸化鉄 (Fe(OH)₃):【生成物】鉄、酸素、水が化合してできた、いわゆる「サビ」の一種。この物質が生まれるときに熱が発生します。
そして、市販のカイロにはさらに工夫が凝らされています。

- 活性炭:【スーパーアシスタント】表面に無数の小さな穴が開いており、そこに空気中の酸素を大量に吸着します。鉄の周りに酸素を集めて、反応を持続的かつ効率的に進める重要な役割を担っています。
- バーミキュライト、木粉、吸水性樹脂:【調整役】保水性を高めて反応を長持ちさせたり、発生した熱をカイロ全体に均一に広げたりする役割があります。彼らのおかげで、カイロは急に熱くなりすぎず、長時間あたたかさを保つことができるのです。

安全に楽しむための約束
この実験は比較的安全ですが、鉄粉が酸化している最中は高温になります。反応が終わって十分に冷めるまでは、絶対にゴミ箱に捨てないでください。実験後は紙コップごと安全な場所に保管し、翌日以降に先生の指示に従って処分しましょう。たった一つの使い捨てカイロにも、これだけの科学的な知恵と工夫が詰まっています。身の回りのモノに「なぜ?」と問いかけると、世界はもっと面白く見えてくるはずです。
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!
・運営者・桑子研についてはこちら
・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら
・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



