金属たちの椅子取りゲーム!「イオンになりたい!」王者を決める金属のイオン化傾向実験(マイクロスケール実験)
サイエンストレーナーの桑子研です。毎日が実験。
なぜ鉄の釘はサビるのに、金(ゴールド)の指輪はいつまでも輝き続けるのでしょうか?なぜ乾電池は、金属の組み合わせで電気が生まれるのでしょうか?その秘密は、金属たちが「イオンになりたい!」と願う気持ちの強さ、すなわち「金属のイオンへのなりやすさ」に隠されています。
今日は、この目には見えない金属たちの「本気度」を、マイクロスケール(超小型)で実施できるエコな実験をご紹介します!ポイントは「少量の試薬・観察性・安全性」です。中学生にもわかりやすく、しかも準備が少なくて済むのが嬉しいところ。化学が好きな生徒も、「ちょっと苦手かも…」という生徒も、色の変化にワクワクすること間違いなしです。
「金属が水溶液中でイオンになる」と聞くとピンとこないかもしれませんが、実際に金属の色が変わったり、溶液の青色が消えたりする劇的な変化を見ることで、「ああ、こういうことか!」と深く理解できます。さらに、マイクロプレートやプチボトルを使うことで廃液を劇的に減らし、実験の環境負荷も最小限に。
今回はその準備から観察、そして「なぜそうなるのか?」という考察まで、詳しくご紹介します。
用意するもの
道具・試薬 説明— | —銅板、亜鉛板、マグネシウム板 | 今回の主役、3種類の金属選手
- 3%硫酸銅水溶液 | 銅イオン(青色)
- 3%硫酸亜鉛水溶液 | 亜鉛イオン(無色)
- 3%硫酸マグネシウム水溶液 | マグネシウムイオン(無色)
 💡 おすすめアイテム:ナリカ製のプチボトル(こちら)は1滴ずつコントロールしやすく、100円ショップのものとは使用感が全く違います。
💡 おすすめアイテム:ナリカ製のプチボトル(こちら)は1滴ずつコントロールしやすく、100円ショップのものとは使用感が全く違います。

https://www.rika.com/product/detailed/S75-1140-02
他に必要なものは、マイクロプレート (少量で反応を観察できるプレート)、ピンセット、保護メガネです。
試薬の準備(3%溶液の作り方)
試薬の調整については次のとおりです。少し専門的になりますが、先生向けのメモです。
3%硫酸銅水溶液の作り方:硫酸銅(Ⅱ)5水和物(CuSO4・5H20)4.9g+水100gを融解させる
3%硫酸亜鉛水溶液の作り方:硫酸亜鉛七水和物(ZnS04・7H20)5.6g+水100gを融解させる。
3%硫酸マグネシウム水溶液の作り方:硫酸マグネシウム七水和物(MgSO4・7H20)6.5g+水100gを融解させる。
実験の手順
金属板の準備
各金属板を軽くやすりがけして、表面に光沢を出しておきます。これは表面の酸化した膜(サビなど)を取り除き、金属の「素顔」を出すため。反応が格段に起こりやすくなります。
マイクロプレートに金属を配置
プレートの各セル(小さなくぼみ)に、3種類の金属片を置きます。(9つのセルを使って、3種類の金属 × 3種類の水溶液 の全パターンを試します)
各水溶液を滴下するプチボトルでそれぞれの金属に対して水溶液を3滴程度ずつ滴下します。反応を観察色の変化、泡の発生、金属表面の様子の3点に注目します。
実験結果と観察例
実際に実験をしてみた結果がこちらです。
こちらがセルの様子です。全部で9パターンのうち、いくつかのセルで明らかな反応が見られました(画像では左下3つのセルなど)。

特に劇的だったのは、青色の硫酸銅水溶液に入れた金属たちの様子です。
【硫酸銅水溶液 × マグネシウム板】
 左が反応前、右が反応後
左が反応前、右が反応後

マグネシウムチップが少し薄くなっています(溶けています)。

右が新品、左が反応後。表面が黒くなっています。
マグネシウムを入れると、表面がすぐに黒っぽくなり、青かった溶液の色が薄くなっていきます! マグネシウム板自体も少し溶けて(薄くなって)います。
【硫酸銅水溶液 × 亜鉛板】
 左が反応前、右が反応後
左が反応前、右が反応後 亜鉛板も同様に、表面に赤っぽい付着物がつきました。マグネシウムほど激しくはありませんが、明らかに反応しています。
亜鉛板も同様に、表面に赤っぽい付着物がつきました。マグネシウムほど激しくはありませんが、明らかに反応しています。
【硫酸銅水溶液 × 銅板】
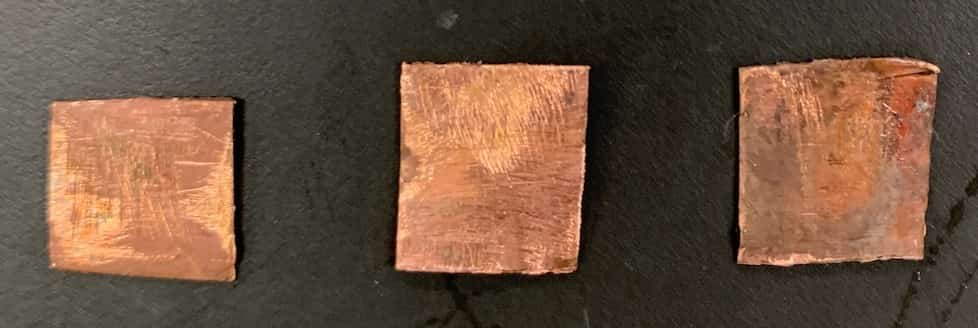 銅板は、硫酸銅水溶液に入れてもまったく変化がありませんでした。
銅板は、硫酸銅水溶液に入れてもまったく変化がありませんでした。
まとめると、組み合わせで観察された変化としては、
硫酸銅 × マグネシウム 金属表面が黒くなる、沈殿出現
硫酸銅 × 亜鉛 金属表面に赤っぽい付着物
硫酸銅 × 銅 変化なし
ということになります。
考察:金属のイオンになりやすさ(イオン化傾向)
これらの反応結果から、電子を放出してイオンになりやすい金属の順序(=イオン化傾向)が導けます。
マグネシウム > 亜鉛 > 銅
マグネシウムは最も積極的に反応し、銅は逆に何も変化がありません。これは、マグネシウムが電子を放出しやすく、イオン化しやすいことを示しています。
まとめと授業活用ポイント
省スペース・低コスト・安全の三拍子揃ったマイクロスケール実験。「青色が消える」「赤い金属が出てくる」など、色の変化が劇的で、化学変化を実感しやすいです。考察の流れが「なぜ?」を解き明かすストーリーになり、グループワークにも最適です。廃液もマイクロプレートのセル数滴分なので、後片付けが簡単で環境にも優しい!
イオン化傾向の理解は、中学理科で学ぶ「ダニエル電池」(亜鉛と銅のイオン化傾向の差を利用して電気を取り出す装置)や、高校化学の「金属の腐食(サビ)」にもつながる非常に重要な基礎です。
ぜひこの楽しい実験で、化学の面白さを一緒に探究していきましょう!
マイクロスケール実験 amazon
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!・運営者・桑子研についてはこちら・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!


