हाइड्रोक्लोरिक एसिड, सल्फ्यूरिक एसिड, अमोनिया और कॉपर क्लोराइड को सही तरह से कैसे पतला करें: सुरक्षित प्रयोगशाला तैयारी के लिए बुनियादी बातें सीखें!
मैं कुवाको केन, आपका साइंस ट्रेनर हूँ। हर दिन एक नया प्रयोग!

【इस लेख को अंग्रेजी में पढ़ें】
विज्ञान प्रयोगशाला में रसायनों का उपयोग करते समय, “सुरक्षित, सटीक और कुशलता से” प्रयोग करने के लिए तनुकरण (dilution) का मूलभूत ज्ञान आवश्यक है। इस बार, मैंने शिक्षकों के लिए रसायनों का उपयोग करते समय ध्यान रखने योग्य तनुकरण के तरीके, सुरक्षा पहलू और वास्तविक प्रयोगों में सांद्रता के अनुमानों को संकलित किया है। यह मूल रूप से कुछ ऐसा था जिसकी मैंने खुद जिज्ञासावश खोज की और संकलित किया, लेकिन “अच्छी तरह से तैयारी” मन को शांति देती है, और त्रुटिरहित तैयारी कक्षा की गुणवत्ता को बनाए रखती है। इस लेख को पढ़कर, आप आमतौर पर उपयोग किए जाने वाले रसायनों के तनुकरण की अवधारणा को पूरी तरह से समझ पाएंगे।
उदाहरण के लिए, हामाजिमा शोतेन की विज्ञान हैंडबुक के पृष्ठ 243 में तनुकरण के तरीकों और बनाने के तरीके का सारांश दिया गया है। सोडियम हाइड्रॉक्साइड के इलेक्ट्रोलाइसिस के लिए 5% की सांद्रता ठीक है। यह भी पता चलता है कि हाइड्रोक्लोरिक एसिड के इलेक्ट्रोलाइसिस के लिए 5% की सांद्रता ठीक है। इस पृष्ठ पर, समाधान बनाने के वास्तविक तरीके के बारे में विस्तार से और क्षेत्र के शिक्षकों के लिए जानकारी संकलित की गई है। वास्तविक द्रव्यमान प्रतिशत सांद्रता से मोलर सांद्रता में रूपांतरण जैसी गणना विधियों को एक अलग लेख में संकलित किया गया है। कृपया इसे देखें।
हाइड्रोक्लोरिक एसिड के तनुकरण के बारे में
ऐसा कहा जाता है कि मिडिल स्कूल के विज्ञान प्रयोगों में अक्सर इस्तेमाल होने वाले हाइड्रोक्लोरिक एसिड को एक बार में पतला हाइड्रोक्लोरिक एसिड को पतला करके उपयोग करना सबसे अच्छा है। 10% हाइड्रोक्लोरिक एसिड बनाने के लिए, आयतन अनुपात में 1 भाग सांद्र हाइड्रोक्लोरिक एसिड में 3.2 भाग पानी मिलाया जाता है। उदाहरण के लिए, यदि आप 500 cubic centimeter सांद्र हाइड्रोक्लोरिक एसिड को पूरी तरह से 10% बनाना चाहते हैं, तो इसे 1600 cubic centimeter पानी से पतला करना सबसे अच्छा है, इसलिए इसे 3 लीटर के पॉलीथीन कंटेनर (अमेज़ॅन) में पतला करके स्टोर करना सुविधाजनक है।

|
|
इस साइट पर हाइड्रोक्लोरिक एसिड सांद्रता रूपांतरण तालिका भी देखें।
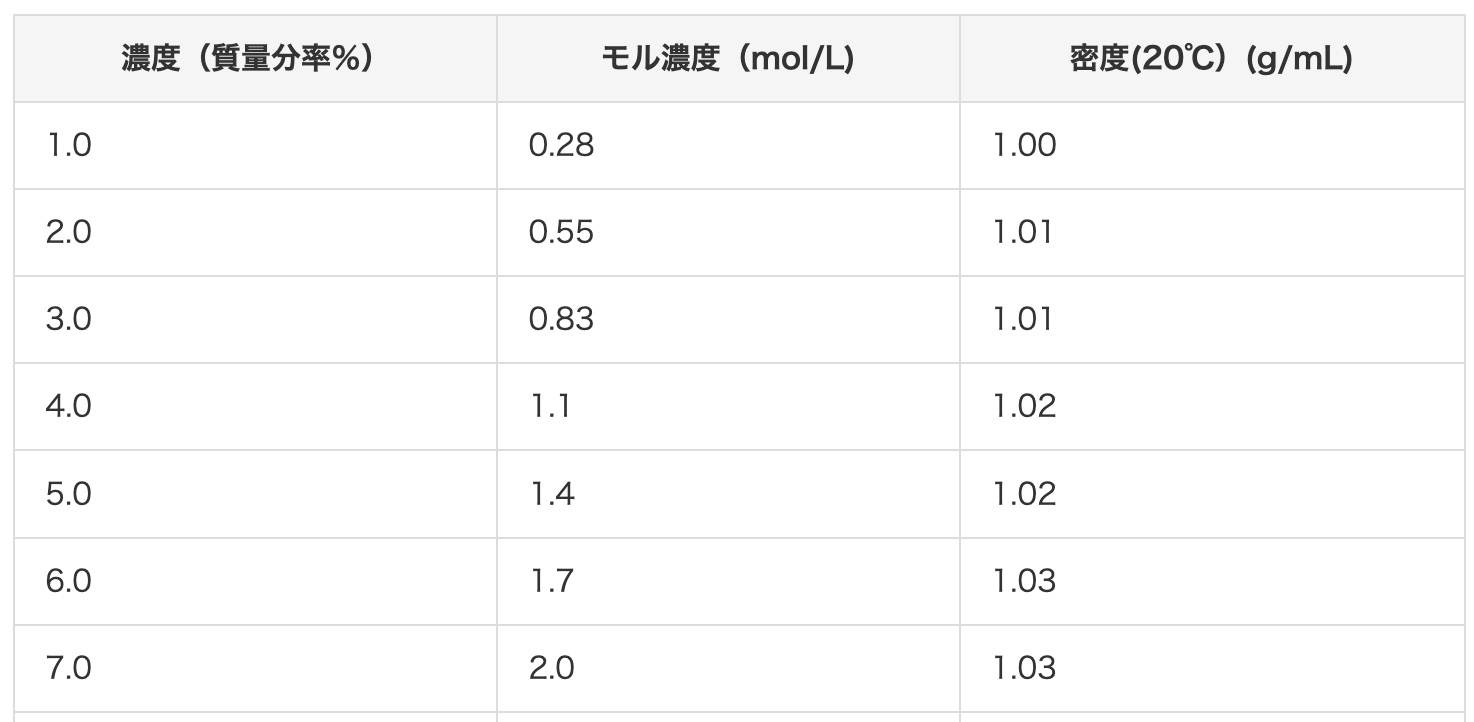
तनुकरण के तरीके के लिए, कृपया इसे देखें।
यदि आप चिंतित हैं, तो सूत्रों से भी इसकी पुष्टि करें।
उदाहरण के लिए, सांद्र हाइड्रोक्लोरिक एसिड 12 mol/L है, और घनत्व 1.18 g/mL है, तो 1 लीटर (1000 mL) सांद्र हाइड्रोक्लोरिक एसिड घोल का द्रव्यमान है:
1.18 × 1000 = 1180 g
इसके अलावा, यदि विलेय का आणविक भार 36.5 है, तो विलेय का द्रव्यमान है:
12 × 36.5 = 438 g
इसलिए, सांद्र हाइड्रोक्लोरिक एसिड की द्रव्यमान प्रतिशत सांद्रता है:
438 / 1180 = 37.1%
इस सांद्रता को पानी मिलाकर 10% करने के लिए, यदि मिलाए गए पानी की मात्रा x [g] है, तो:
438 / (1180 + x) = 10 / 100
x = 3200 g
होगा। इसलिए, 1 लीटर हाइड्रोक्लोरिक एसिड में 3.2 लीटर पानी मिलाने पर, सांद्रता 10% हाइड्रोक्लोरिक एसिड होगी। यदि हाइड्रोक्लोरिक एसिड 500 mL है, तो यह उसका आधा है, इसलिए यह 1.6 लीटर होगा।
सावधानी
जब हाइड्रोक्लोरिक एसिड को पतला करते हैं, तो एसिड को पानी में मिलाना सुनिश्चित करें। यदि आप एसिड या क्षार में पानी मिलाते हैं (गलत तरीका), तो घुलनशीलता के कारण होने वाली गर्मी से मिलाया गया पानी फैल सकता है। मैंने हाइड्रोक्लोरिक एसिड और सल्फ्यूरिक एसिड को पतला करने के तरीकों के लिए कुछ उपयोगी साइटें संकलित की हैं। यह ध्यान दिया जाना चाहिए कि सांद्र हाइड्रोक्लोरिक एसिड और सांद्र सल्फ्यूरिक एसिड की सांद्रता में अंतर घुलनशीलता में अंतर के कारण होता है।

9 प्रतिशत सांद्रता के मामले में, सामान्यता N लगभग 2.6 (2.6 mol/L) है
4 प्रतिशत सांद्रता के मामले में, सामान्यता N लगभग 1 (1 mol/L) है
संदर्भ: http://www.keins.city.kawasaki.jp/9/ke9004/benrihp060821/2020.benrichou.ensan.pdf
सांद्र हाइड्रोक्लोरिक एसिड की सांद्रता 12 mol/L है। इसलिए, 1 mol/L की सांद्रता प्राप्त करने के लिए इसे 12 गुना पतला करना होगा। कुल मात्रा 12 है जिसमें 1 भाग हाइड्रोक्लोरिक एसिड है, इसलिए हाइड्रोक्लोरिक एसिड 1: पानी 11 के अनुपात में मिलाना सबसे अच्छा है।
※सावधानी जब तनुकरण कर रहे हों, तो एसिड या क्षार में पानी मिलाने से घुलनशीलता के कारण गर्मी पैदा हो सकती है, जिससे मिलाया गया पानी बिखर सकता है और खतरनाक हो सकता है। तनुकरण करते समय, हमेशा एसिड या क्षार को पानी में मिलाना सुनिश्चित करें।
【हाइड्रोक्लोरिक एसिड के मामले में】
・ सांद्र हाइड्रोक्लोरिक एसिड की सांद्रता 12 mol/L है। इसलिए, 1 mol/L की सांद्रता प्राप्त करने के लिए इसे 12 गुना पतला करना होगा। कुल मात्रा 12 है जिसमें 1 भाग हाइड्रोक्लोरिक एसिड है, इसलिए हाइड्रोक्लोरिक एसिड 1: पानी 11 के अनुपात में मिलाना सबसे अच्छा है।
(उदाहरण) 110 mL पानी में 10 mL हाइड्रोक्लोरिक एसिड मिलाएं।
※सावधानी जब तनुकरण कर रहे हों, तो एसिड या क्षार में पानी मिलाने से घुलनशीलता के कारण गर्मी पैदा हो सकती है, जिससे मिलाया गया पानी बिखर सकता है और खतरनाक हो सकता है। तनुकरण करते समय, हमेशा एसिड या क्षार को पानी में मिलाना सुनिश्चित करें।
【अमोनिया पानी के मामले में】
・ सांद्र अमोनिया पानी 14 mol/L है। इसलिए, 1 mol/L अमोनिया पानी बनाने के लिए, सांद्र अमोनिया पानी 1: पानी 13 के अनुपात में मिलाना सबसे अच्छा है।
※ यदि विलेय एक तरल है, तो मोलर सांद्रता, और यदि यह एक ठोस है, तो आणविक भार ज्ञात होने पर वांछित सांद्रता का एक जलीय घोल बनाया जा सकता है।संदर्भ http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
सोडियम हाइड्रॉक्साइड के तनुकरण के बारे में
सोडियम हाइड्रॉक्साइड जलीय घोल सांद्रता त्वरित संदर्भ तालिका
【सोडियम हाइड्रॉक्साइड के मामले में】
・ सोडियम हाइड्रॉक्साइड का 1 मोल 40 ग्राम है। इसलिए, जब 40 ग्राम सोडियम हाइड्रॉक्साइड को पानी में घोलकर 1 लीटर बनाया जाता है, तो यह 1 mol/L होता है।
1 mol/L (4%) सोडियम हाइड्रॉक्साइड जलीय घोल का 100 mL बनाने के लिए, 4 ग्राम सोडियम हाइड्रॉक्साइड को पानी में घोलकर 100 mL बनाया जाता है।
※ सोडियम हाइड्रॉक्साइड पानी में घुलने पर उष्माक्षेपी अभिक्रिया करता है। इसलिए, कम मात्रा में पानी में घोलें और पानी का तापमान बढ़ने के बाद शेष को घोलें तो यह आसान होता है।संदर्भ http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
◆ बड़ी मात्रा में घोल (लगभग 500 mL या अधिक) बनाने के लिए
एक मेजरिंग सिलेंडर (उदाहरण के लिए, यदि आप 500 mL बनाना चाहते हैं तो 500 mL या 1000 mL) का उपयोग करके आसुत जल को मापें, आधे को एक बड़े बीकर A में स्थानांतरित करें, और शेष को मेजरिंग सिलेंडर में छोड़ दें।
एक तराजू का उपयोग करके एक अलग बीकर B में सोडियम हाइड्रॉक्साइड को मापें, और तुरंत इसे 1 के बीकर A में आसुत जल में मिलाएं और अच्छी तरह हिलाएं। बीकर B के नीचे चिपके हुए सोडियम हाइड्रॉक्साइड को मेजरिंग सिलेंडर से आसुत जल मिलाकर घोलने के बाद 1 के बीकर A में स्थानांतरित करें।
यदि आवश्यक हो, तो इसे रीजेंट बोतल में स्थानांतरित करके स्टोर करें। रीजेंट का नाम, सांद्रता, बनाने की तारीख और बनाने वाले का नाम लिखने वाला लेबल संलग्न करें।
◆ कम मात्रा में घोल (लगभग 500 mL से कम) बनाने के लिए
एक मेजरिंग सिलेंडर (उदाहरण के लिए, यदि आप 100 mL बनाना चाहते हैं तो 100 mL या 200 mL) का उपयोग करके आसुत जल को मापें।
एक तराजू का उपयोग करके बीकर में सोडियम हाइड्रॉक्साइड को मापें, और तुरंत 1 में मापे गए आसुत जल को मिलाएं और अच्छी तरह हिलाएं।
यदि आवश्यक हो, तो इसे रीजेंट बोतल में स्थानांतरित करके स्टोर करें। रीजेंट का नाम, सांद्रता, बनाने की तारीख और बनाने वाले का नाम लिखने वाला लेबल संलग्न करें।
कॉपर क्लोराइड के इलेक्ट्रोलाइसिस के लिए सांद्रता समायोजन के बारे में
इलेक्ट्रोलाइसिस के लिए कॉपर क्लोराइड घोल के समायोजन के लिए, 13 ग्राम कॉपर क्लोराइड लिया गया और आसुत जल मिलाकर 300 ग्राम घोल बनाया गया। यह लगभग 3% कॉपर क्लोराइड जलीय घोल है। अधिक जानकारी के लिए, कृपया इसे देखें। घोल पतला है, लेकिन प्रयोग पर्याप्त रूप से किया जा सकता है।
डेनियल सेल के लिए सांद्रता समायोजन के बारे में
#जिंक सल्फेट जलीय घोल 5 प्रतिशत 9.8 ग्राम जिंक सल्फेट में 100 ग्राम पानी #कॉपर सल्फेट जलीय घोल लगभग 17 प्रतिशत 35.7 ग्राम कॉपर सल्फेट में 100 ग्राम पानी
मैंने यहां अधिक जानकारी संकलित की है।
अन्य उपयोगी साइटें
*एसिडिक/क्षारीयता की जांच का प्रयोग इस प्रयोग में लिटमस पेपर का रंग बदलना पर्याप्त है, इसलिए आमतौर पर लगभग 0.3-1 mol/L पर्याप्त है। यदि 0.3 mol/L है, तो सांद्र हाइड्रोक्लोरिक एसिड: पानी = 1:39 *धातु डालकर हाइड्रोजन उत्पन्न करने का प्रयोग धातु को घोलने के प्रयोग में, एक निश्चित सांद्रता की आवश्यकता होती है। इसे लगभग 3 mol/L तक पतला करें। सांद्र हाइड्रोक्लोरिक एसिड: पानी = 1:3
संदर्भ https://www.ice.or.jp/nc/?action=common_download_main&upload_id=1169
◆अंत में
“शायद थोड़ा ज़्यादा गाढ़ा हो गया…” “क्या मुझे इसे और पतला करना चाहिए था?” ऐसी चिंताएँ पूर्व ज्ञान और तैयारी से दूर की जा सकती हैं। तनुकरण के तरीकों को ठीक से समझकर, प्रयोगों के दौरान सुरक्षा भी बढ़ती है, और छात्रों को विज्ञान का सही दृष्टिकोण सिखाने में भी मदद मिलती है। रसायनों को संभालते समय पूरी सावधानी बरतते हुए, आइए विज्ञान के मज़े और गहराई को बच्चों तक पहुँचाएँ!
पूछताछ और अनुरोध के बारे में
विज्ञान के रहस्यों और रोचकता को और भी करीब से जानें! घर पर किए जा सकने वाले मजेदार विज्ञान प्रयोगों और उनके गुर को आसानी से समझाकर बताया गया है। खूब खोजबीन करें!
・संचालक, कुवाको केन के बारे में यहाँ
・विभिन्न अनुरोधों (लेखन, व्याख्यान, प्रयोग कक्षाएं, टीवी पर्यवेक्षण, उपस्थिति आदि) के लिए यहाँ
・लेखों के अपडेट X पर लाइव हैं!
![]() विज्ञान के आइडिया का चैनल प्रयोग वीडियो प्रसारित कर रहा है! (अभी सब्सक्राइब करें!)
विज्ञान के आइडिया का चैनल प्रयोग वीडियो प्रसारित कर रहा है! (अभी सब्सक्राइब करें!)
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[उत्पाद की कीमत लिंक बनाए जाने के समय और वर्तमान समय के बीच बदल सकती है।] [उत्पाद की कीमत लिंक बनाए जाने के समय और वर्तमान समय के बीच बदल सकती है।]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)

