¿A dónde se fue la electricidad? El misterio del emotivo “gráfico en V” de la neutralización (Experimento con hidróxido de bario y ácido sulfúrico)
Hola, soy Ken Kuwako, entrenador científico. ¡Cada día es un nuevo experimento!
En esta ocasión, les presento una de las prácticas de laboratorio más emocionantes y visuales de la química: la reacción de neutralización entre el hidróxido de bario y el ácido sulfúrico. Este experimento no es solo una simple mezcla; es fascinante porque permite ver cómo los iones desaparecen de la solución a través del movimiento de la aguja de un amperímetro. Al graficar los datos, obtenemos una curva en forma de V sorprendentemente perfecta. ¡Aquí les explico desde los trucos de preparación hasta el emocionante final!
Preparación previa: ¡El secreto está en el líquido transparente!
Comencemos con los preparativos. Una organización precisa es el primer paso para un experimento seguro y exitoso.
Cómo preparar la solución de hidróxido de bario
Una vez decidida la fecha de la clase, disuelvan una buena cantidad de hidróxido de bario en agua y déjenlo reposar tranquilamente durante unos días. Lo que utilizaremos es el líquido transparente de la parte superior, llamado sobrenadante. Como el hidróxido de bario es una base fuerte, es obligatorio usar gafas de protección. Debido a que reacciona fácilmente con el dióxido de carbono del aire formando una capa blanca (carbonato de bario), no conviene almacenarlo por mucho tiempo; es mejor prepararlo para cada experimento. Tapen el vaso de precipitados con film plástico para conservarlo.

Guía de cantidades (para 4 grupos): Si añaden unos 10g de hidróxido de bario octahidratado a 220mL de agua, obtendrán una solución saturada. Por ejemplo, si tienen 8 grupos y cada uno usa 5mL, necesitan 40mL. Para 4 clases, con 160mL será suficiente (es un cálculo generoso).

A la izquierda, recién hecho; a la derecha, tras reposar una semana. Se vuelve transparente y aparece una película en la superficie.
Ajuste del ácido sulfúrico (¡Regla de oro de la dilución!)
Ahora, preparemos el ácido sulfúrico. Hay una regla inquebrantable que deben seguir: JAMÁS viertan agua sobre ácido sulfúrico concentrado. Esto genera un calor intenso que puede hacer que el líquido salte, lo cual es extremadamente peligroso. Sigan siempre el orden correcto: verter el ácido sulfúrico concentrado poco a poco sobre el agua.
Guía de dilución (para 4 grupos): Añadan con cuidado 3mL de ácido sulfúrico concentrado a 51mL de agua, y luego diluyan esto 10 veces hasta obtener un total de 540mL (aprox. 0.1mol/L).
Coloquen unos 15mL en tubos de ensayo junto con una pipeta para que los alumnos puedan medirlo fácilmente. También preparen vasos de precipitados con 5mL de la solución de hidróxido de bario para cada grupo.

¡Con todo listo, es hora de empezar el experimento!

Así es el circuito. Utilizamos la fuente de alimentación compacta Petit-X, pero cualquier fuente estándar funciona perfectamente.
¡Encendido! Ajuste del voltaje
Conecten la fuente y ajusten el voltaje a 5V para que fluya la corriente. En este punto inicial, hay muchos iones libres, por lo que la corriente fluye con intensidad.

Para medir usamos el Petit-Meter, ¡muy práctico!
Goteo de ácido sulfúrico: 1mL a la vez
Aquí empieza lo bueno. Añadan el ácido sulfúrico de 1 en 1mL, registrando el valor del amperímetro en cada paso.

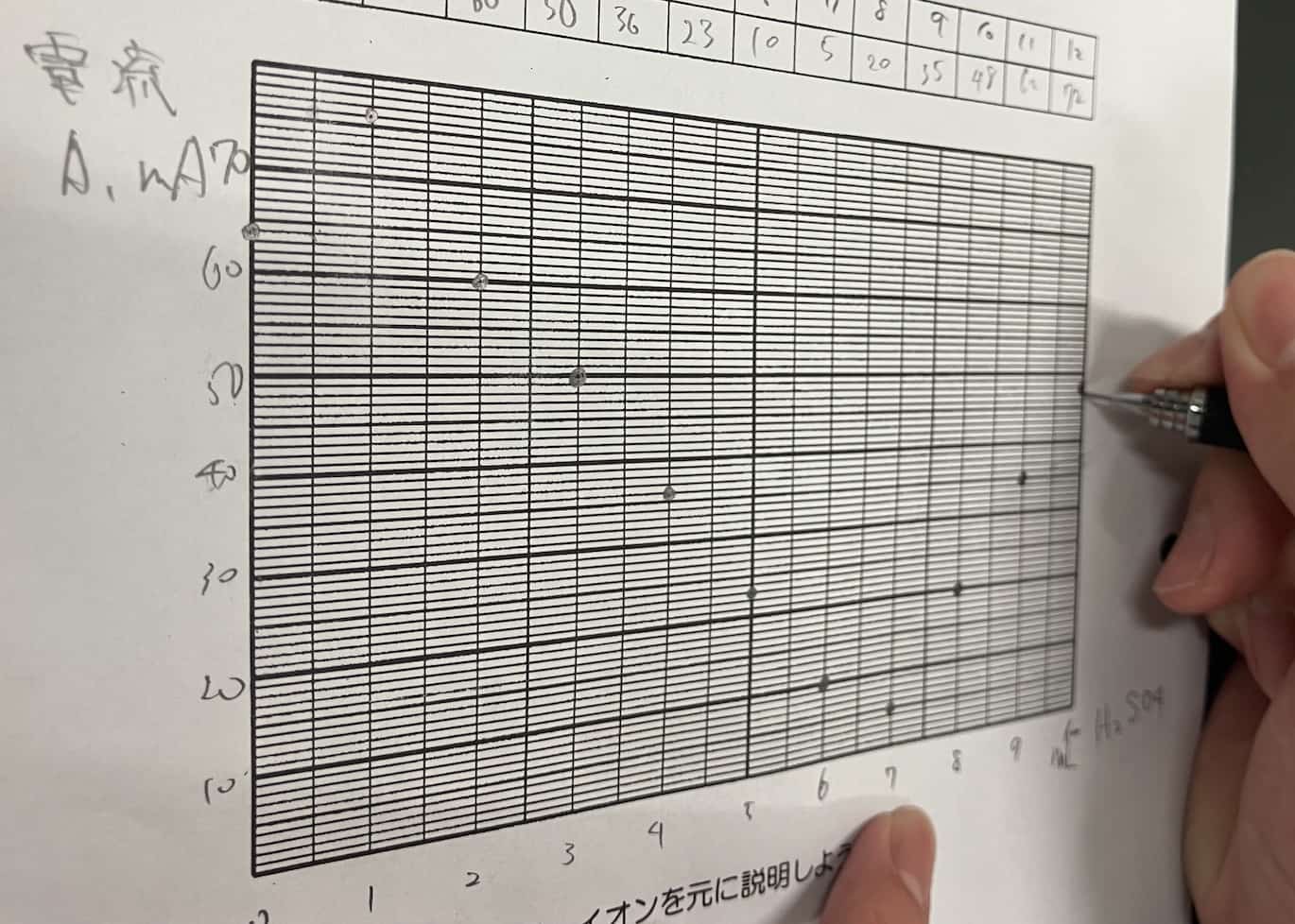
¡La impresionante gráfica en V! ¿Por qué desaparece la corriente?
Al graficar los datos, nos espera un resultado asombroso.
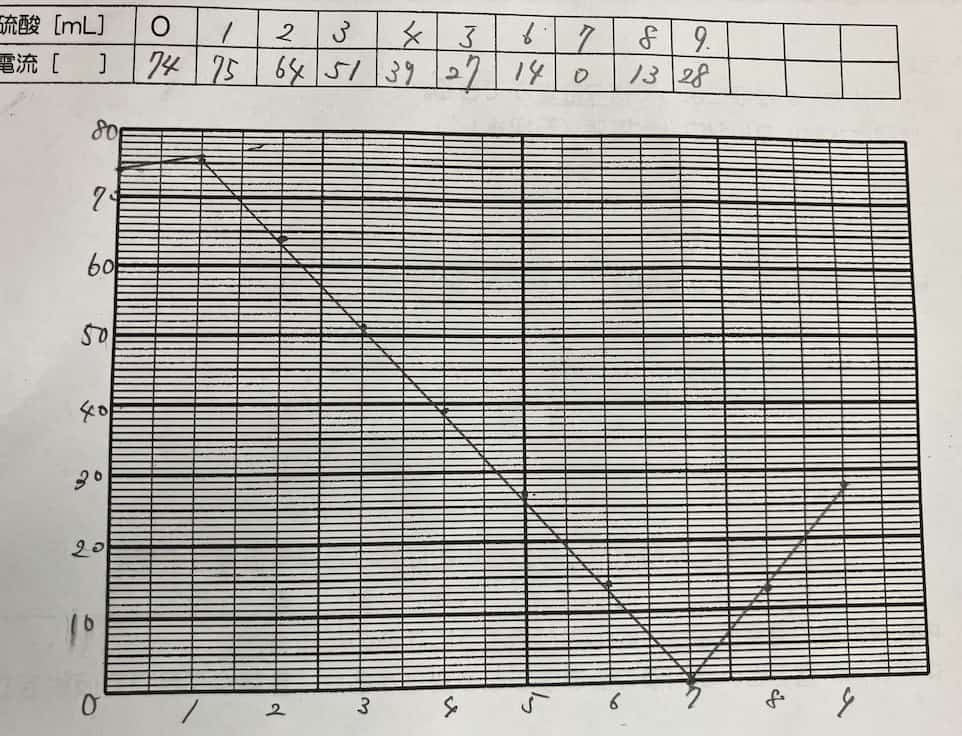
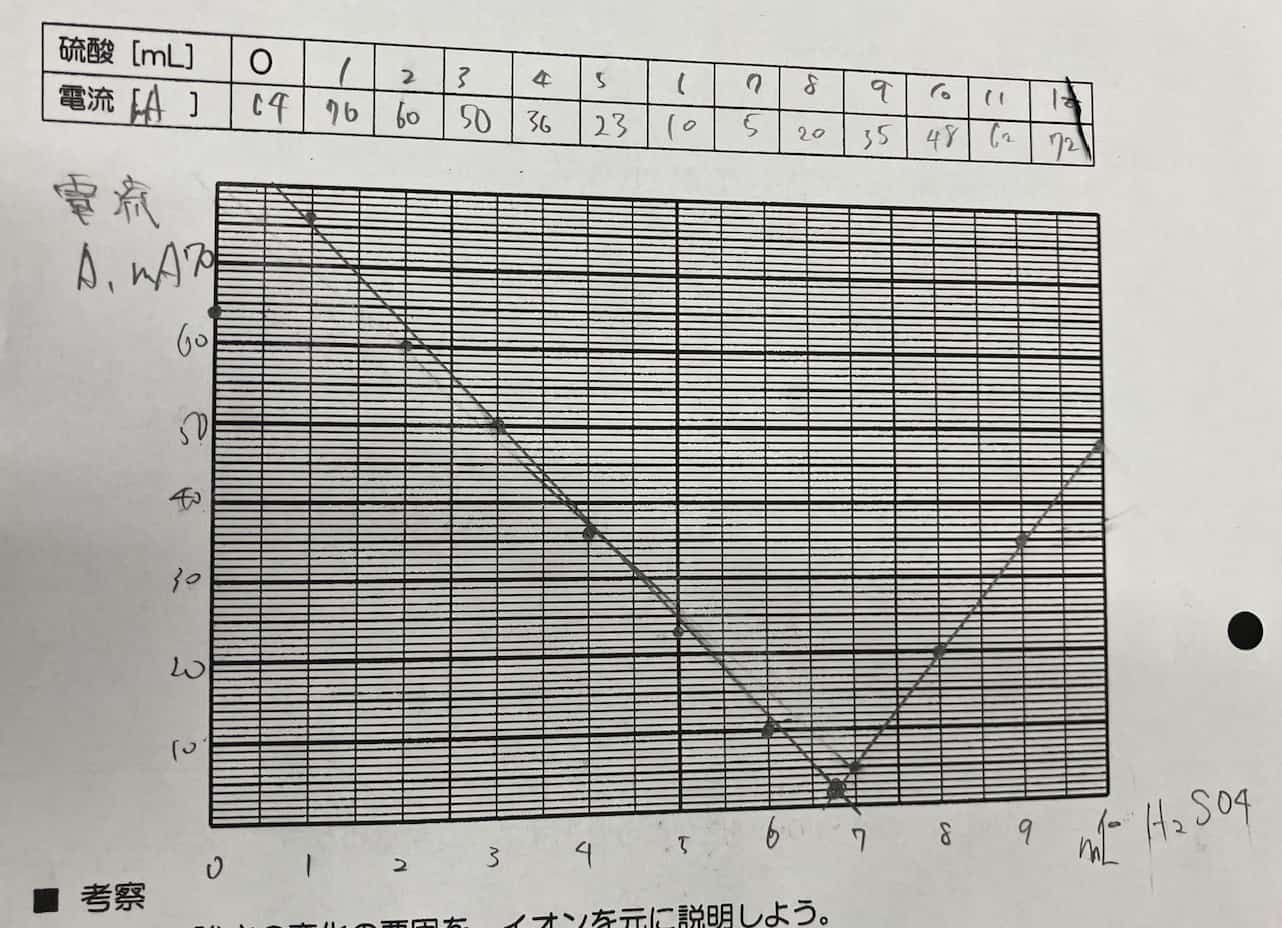
A medida que añadimos el ácido, la corriente disminuye gradualmente hasta llegar a casi cero en un punto determinado. ¡Pero lo increíble es que, al seguir añadiendo ácido, la corriente empieza a subir de nuevo!
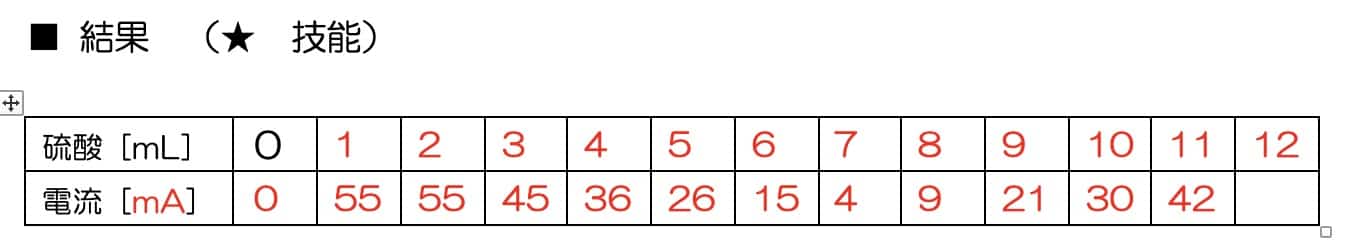
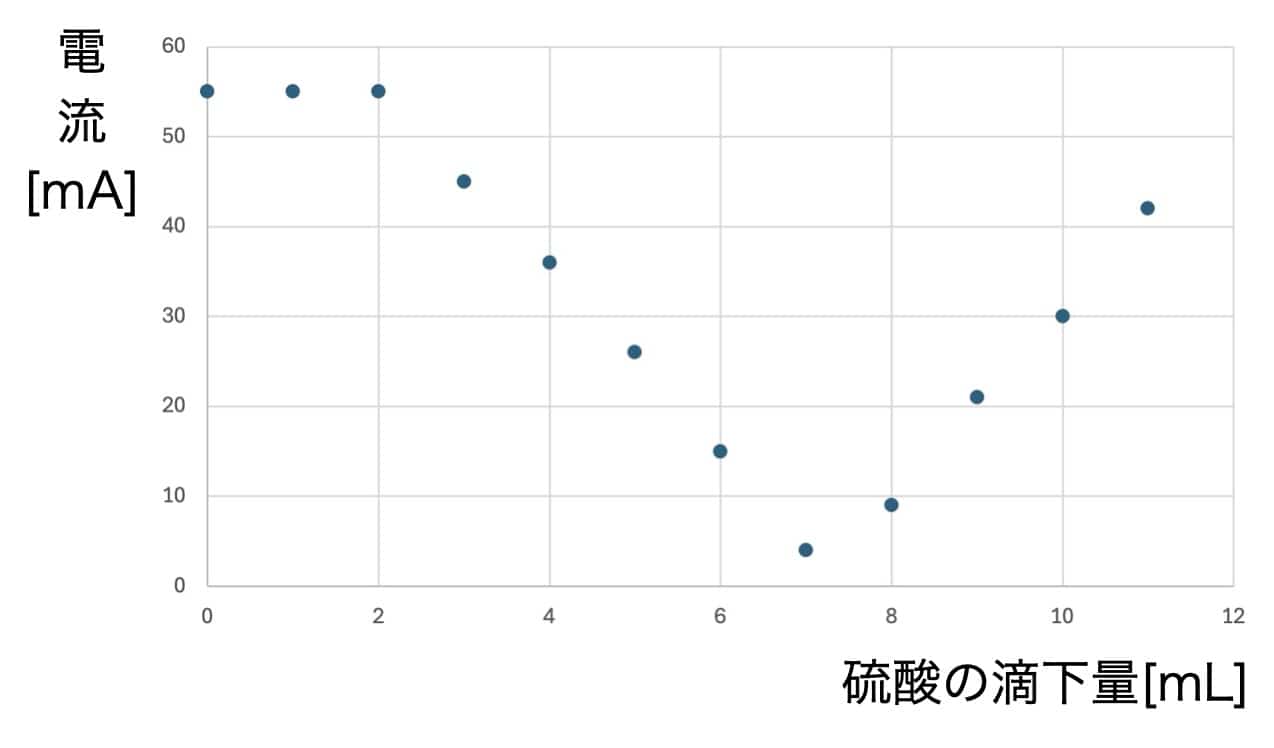
¿Por qué ocurre esta forma de V perfecta? El secreto está en la sal insoluble que se forma durante la reacción. Cuando el hidróxido de bario y el ácido sulfúrico se encuentran, crean sulfato de bario, un precipitado blanco que no se disuelve en agua.
Los iones que transportaban la electricidad en la solución se unen para formar partículas sólidas que caen al fondo. Al quedarse sin transportadores de carga (iones), la corriente deja de fluir. Si seguimos añadiendo ácido sulfúrico, ahora habrá un exceso de iones de dicho ácido, por lo que la corriente vuelve a circular. A diferencia de la reacción entre ácido clorhídrico e hidróxido de sodio (cuya sal, el cloruro de sodio, sí es soluble), aquí la clave es la insolubilidad del producto.
Reflexión final: La magia de la ciencia está en el cambio
Ver cómo la corriente cae hacia el cero absoluto es una experiencia fascinante cada vez. Más allá de leer en un libro que los iones disminuyen, presenciar con tus propios ojos cómo se detiene la aguja del amperímetro te hace sentir que algo real está ocurriendo en ese mundo invisible y microscópico. Este experimento combina la belleza de la química con datos tangibles. ¡Espero que se animen a explorar el drama científico oculto en ese valle de la curva en V!
Contacto y Colaboraciones
¡Hagamos que la maravilla de la ciencia sea algo cotidiano! Aquí encontrarás experimentos divertidos para hacer en casa y consejos fáciles de entender. ¡Explora el sitio!
Mi libro con los mejores trucos científicos está disponible aquí.
Conoce más sobre Ken Kuwako aquí.
Para solicitudes de conferencias, talleres, escritura o consultoría de TV, haz clic aquí.
¡Sigue las novedades en X (Twitter)!
![]() ¡Mira los videos de los experimentos en nuestro canal de YouTube!
¡Mira los videos de los experimentos en nuestro canal de YouTube!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。


