Minne sähkö katosi? Neutralisaation piirtämän vaikuttavan V-muotoisen käyrän salaisuus! (Bariumhydroksidi ja rikkihappo -koe)
Tervehdys kaikille! Olen tiedevalmentaja Ken Kuwako. Minulle jokainen päivä on uusi koe.
Tällä kertaa esittelen teille yhden kemian opettavaisimmista ja dramaattisimmista kokeista: bariumhydroksidin ja rikkihapon välisen neutraloitumisreaktion. Tämä ei ole pelkkää koeputkien kalisteltua, vaan tässä kokeessa pääset näkemään, kuinka ionit kirjaimellisesti katoavat liuoksesta. Ampeerimittarin neula kertoo totuuden, ja kun tulokset piirretään kuvaajaksi, syntyy hämmästyttävän kaunis V-käyrä. Tässä kokeessa tieteen taika tiivistyy – käydäänpä läpi valmistelut ja se, miksi lopputulos on niin sykähdyttävä!
Esivalmistelut: Onnistumisen salaisuus on kirkkaassa liuoksessa
Aloitetaan huolellisilla valmisteluilla. Tarkkuus tässä vaiheessa takaa turvallisen ja onnistuneen kokeen.
Bariumhydroksidiliuoksen valmistus
Kun kokeen ajankohta on selvillä, liuota veteen reilusti bariumhydroksidia ja anna sen seistä rauhassa muutaman päivän ajan. Käytämme kokeessa nimenomaan tuota kirkasta pintaliuosta. Koska bariumhydroksidi on voimakkaasti emäksistä, muista aina käyttää suojalaseja! Aine reagoi herkästi ilmassa olevan hiilidioksidin kanssa muodostaen valkoista kalvoa (bariumkarbonaattia), joten älä tee liuosta varastoon. Valmista uusi erä jokaista koetta varten ja peitä keitinlasi kelmulla säilytyksen ajaksi.

Mitoitusohje (noin 4 luokalle): Lisää noin 10 g bariumhydroksidi-oktahydraattia 220 ml:aan vettä saadaksesi kylläisen liuoksen. Esimerkiksi 8 ryhmän luokalle riittää 40 ml (5 ml per ryhmä), joten 160 ml kattaa hyvin neljän luokan tarpeen.

Vasemmalla juuri tehty liuos, oikealla viikon seissyt. Huomaatko, kuinka liuos kirkastuu ja pintaan muodostuu kalvo?
Rikkihapon laimentaminen (Muista tärkeä järjestys!)
Seuraavaksi valmistetaan rikkihappo. Tässä on noudatettava yhtä ehdotonta sääntöä: älä koskaan kaada vettä väkevään rikkihappoon. Se aiheuttaa rajun lämmönnousun ja happo voi roiskua silmille. Muista aina järjestys: lisää väkevää happoa hitaasti veteen.
Laimennusohje (4 luokalle): Lisää varovasti 3 ml väkevää rikkihappoa 51 ml:aan vettä ja laimenna tämä seos kymmenkertaiseksi, jolloin saat yhteensä 540 ml (noin 0,1 mol/l) liuosta.
Annostele noin 15 ml koeputkiin ja aseta ne pipettien kanssa valmiiksi, jotta oppilaiden on helppo mitata tarvittava määrä. Valmistele myös keitinlasit, joissa on valmiina 5 ml bariumhydroksidiliuosta jokaiselle ryhmälle.

Kun kaikki on valmista, on aika aloittaa itse koe!

Virtapiiri näyttää tältä. Käytin tässä kätevää Petit-X-virtalähdettä, mutta mikä tahansa tavallinen virtalähde käy mainiosti.
Virta päälle! Jännitteen asettaminen
Kytke virtalähde ja aseta jännitteeksi 5 V. Tässä vaiheessa liuoksessa on paljon ioneja, joten sähkö kulkee vaivatta ja mittari näyttää selvää lukemaa.

Käytin virran mittaamiseen pientä ja kätevää ampeerimittaria.
Lisätään rikkihappoa millilitra kerrallaan
Nyt alkaa jännittävä osuus. Lisää rikkihappoa 1 ml kerrallaan ja kirjaa ylös ampeerimittarin lukema jokaisen lisäyksen jälkeen.

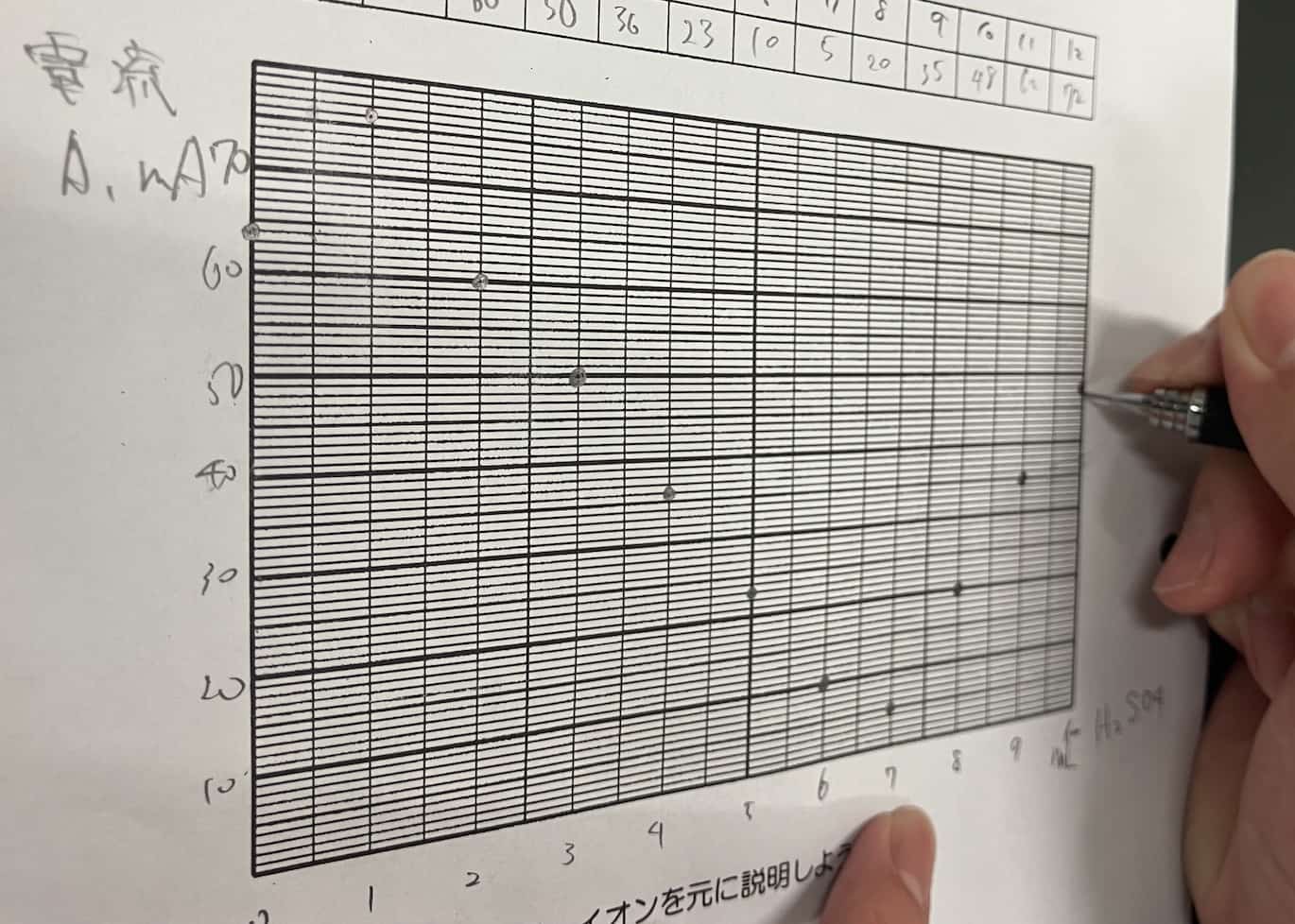
Upea V-kuvaaja! Miksi sähkö katosi?
Kun kerätty data piirretään kuvaajaksi, tulos on pysäyttävä.
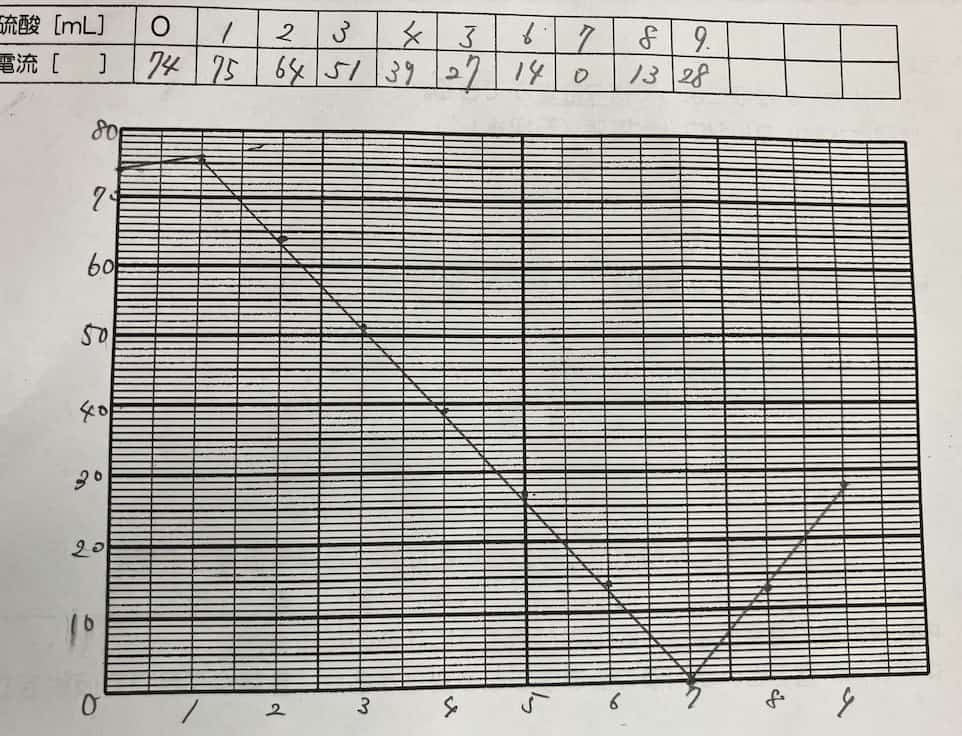
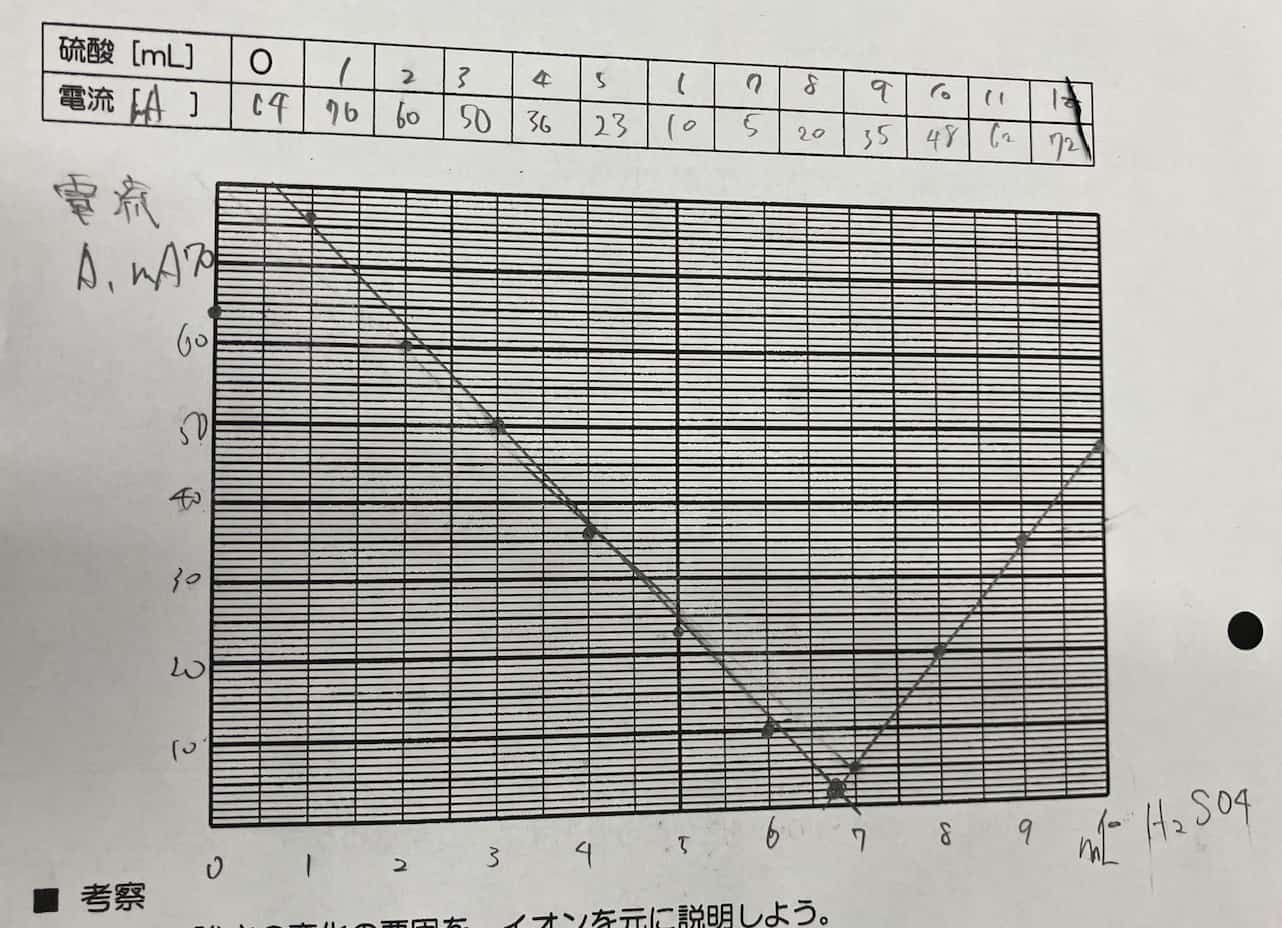
Sähkövirta laskee tasaisesti rikkihapon lisäyksen myötä, kunnes se saavuttaa pisteen, jossa virta on lähes nolla. Mutta kun happoa lisätään tämän jälkeen, virta alkaakin taas nousta!
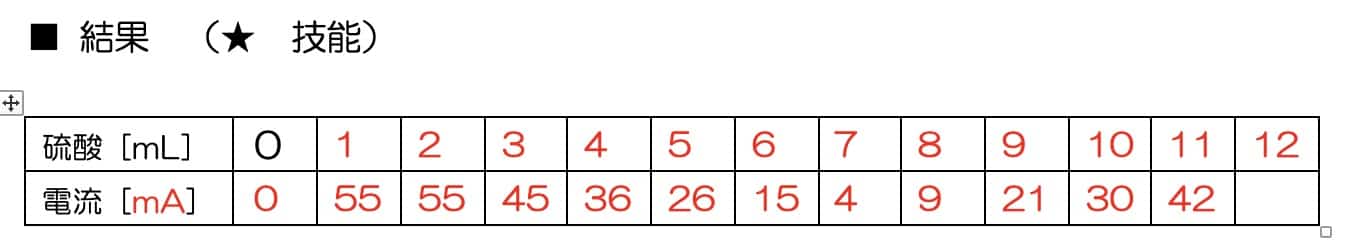
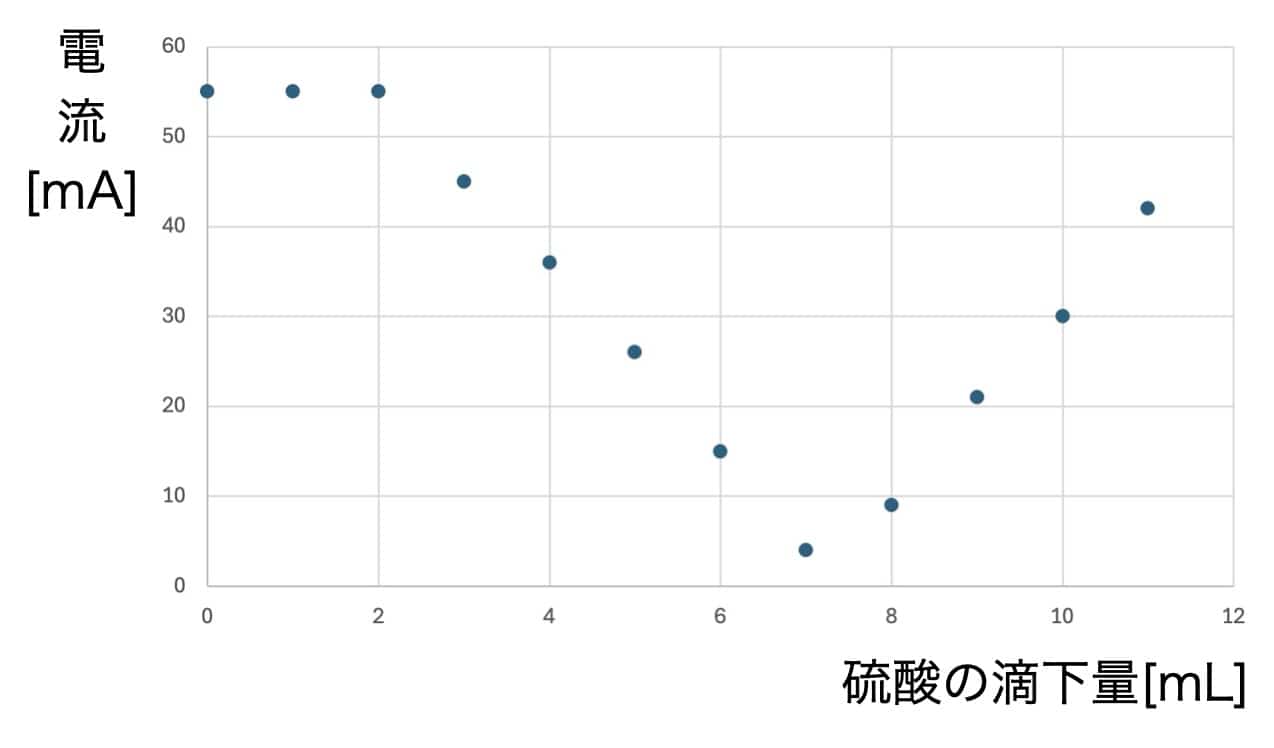
Mikä selittää tämän täydellisen V-muodon? Salaisuus piilee reaktiossa syntyvässä vaikealiukoisessa suolassa. Kun bariumhydroksidi ja rikkihappo kohtaavat, ne muodostavat bariumsulfaattia, joka on veteen liukenematonta valkoista saostumaa.
Liuoksessa sähköä kuljettaneet ionit yhdistyvät ja muuttuvat kiinteiksi hiukkasiksi, jotka vajoavat pohjaan. Koska sähkön kuljettajia (ioneja) ei enää ole vapaana, virta lakkaa kulkemasta. Kun happoa lisätään vielä enemmän, liuokseen tulee ylimääräisiä rikkihapon ioneja, ja virta alkaa jälleen kulkea. Vertailun vuoksi: suolahapon ja natriumhydroksidin reaktiossa syntyvä ruokasuola (natriumkloridi) liukenee veteen, joten vastaavaa ilmiötä ei tapahdu. Tämän kokeen ydin on nimenomaan tuo vaikealiukoisuus.
Lopuksi: Luonnonopin riemu löytyy muutoksesta
On kiehtovaa seurata, kuinka virta hiipuu kohti nollaa sekunti sekunnilta. Oppikirjasta on helppo lukea, että ionit vähenevät, mutta se, että näkee ampeerimittarin neulan pysähtyvän omien silmiensä edessä, antaa aivan eri tason ymmärryksen. Se saa meidät tajuamaan, että näkymättömässä mikromaailmassa tapahtuu jotain suurta. Toivon, että tekin pääsette kokeilemaan tätä kemiaa ja kokemaan V-käyrän laaksoon kätketyn tieteellisen draaman!
Kyselyt ja yhteistyö
Haluatko tuoda tieteen ihmeet lähemmäs arkea? Olen koonnut sivuilleni vinkkejä hauskoihin kotikokeisiin ja selkeisiin ohjeisiin. Käy tutustumassa! ・Tiedekansioni on nyt julkaistu kirjana! Lue lisää täältä. ・Lue lisää minusta (Ken Kuwako) täältä. ・Yhteydenotot (kirjoitustyöt, luennot, tiedepajat, TV-konsultointi jne.) täältä. ・Seuraa uusimpia päivityksiä X-palvelussa!
![]() Tiedekansio-kanavalla voit katsoa koe-videoita!
Tiedekansio-kanavalla voit katsoa koe-videoita!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。


