¿Qué pasa cuando el ácido se encuentra con la base? Crea los cristales de neutralización: el drama visible de la química (HCl y NaOH)
¡Hola! Soy Ken Kuwako, tu entrenador científico. Cada día es un experimento.
Díganme una cosa, ¿alguna vez se han preguntado qué pasa cuando chocan dos opuestos como lo “ácido” y lo “amargo”? En el fascinante mundo de la ciencia, ocurre un drama asombroso llamado neutralización, donde sustancias con personalidades muy fuertes se dan la mano y anulan sus poderes entre sí. Hoy les traigo un experimento emocionante para descubrir las “huellas visibles de la química”: ¡vamos a crear cristales espectaculares! Con materiales muy sencillos, disfrutaremos del cambio de colores y viviremos en carne propia lo profunda que puede ser la ciencia.

¡Manos a la obra! El secreto del éxito está en la precisión
Para que un experimento salga de diez, al igual que en la cocina, la preparación es fundamental. Como ingredientes, usaremos los dos grandes protagonistas: el ácido clorhídrico (un ácido clásico) y el hidróxido de sodio (una base o álcali), ambos en una solución de 0.1 mol/L.
Hablemos un segundo de números. Esta concentración de 0.1 mol/L es el “punto justo” para experimentos escolares: no es una reacción violenta, pero permite que los cambios de color se vean con total claridad.
Para esta sesión, preparamos la mezcla añadiendo 4 mL de ácido clorhídrico a 480 mL de agua. Por otro lado, disolvimos 2 g de hidróxido de sodio en 500 mL de agua. ¡Con esto tenemos material suficiente para que 4 clases enteras (unos 40 grupos) se conviertan en científicos!
¡Empieza el experimento! El momento en que la magia aparece
1. Pintando el ácido con su color característico
Primero, servimos 10 mL de ácido clorhídrico en un vaso de precipitados de 100 mL usando una pipeta. Un truco de experto: pongan una hoja de papel blanco debajo del vaso; verán que el cambio de color resalta muchísimo más. Luego, añadan unas 5 gotas de solución de azul de bromotimol (BTB). ¡Pum! Al instante, el líquido se vuelve un amarillo vibrante. Esto nos confirma que estamos ante una solución ácida.

¡El líquido se volvió amarillo!
Manejar la pipeta requiere un control delicado con la punta de los dedos. Es una de las habilidades básicas de cualquier científico, así que ¡aprovechen para practicar su pulso!
2. El “tira y afloja” de la neutralización
Ahora, empezamos a añadir la solución de hidróxido de sodio de 2 mL en 2 mL, mezclando suavemente con una varilla de vidrio.

Aquí ven la preparación: blanco para el hidróxido de sodio y rojo para el ácido. Para una clase, solemos dejar listos tubos con 4 mL de ácido y 14 mL de hidróxido.
Al principio, la solución amarilla se vuelve azul por un segundo cada vez que cae el hidróxido, pero vuelve rápido al amarillo. Cuando hayamos añadido unos 10 mL, ¡finalmente se quedará azul! Eso significa que nos hemos pasado al lado “alcalino”. Es la señal de que la meta, el “punto de neutralización”, está a la vuelta de la esquina.

¡Se nos fue la mano!
3. ¡Pura diversión! Buscando el “verde perfecto”
Si se puso azul, ahora empieza el verdadero reto. Hay que añadir el ácido clorhídrico gota a gota, con mucho cuidado, hasta lograr el tono verde, que representa el estado neutro.
“¡Uy, se volvió amarillo otra vez!” “¡Ahora está demasiado azul!”
Este vaivén de ajustes es, sinceramente, la parte más emocionante del experimento. Cuando logras ese equilibrio perfecto y aparece un verde precioso, se escuchan gritos de alegría en todo el laboratorio. Los grupos más hábiles pueden alcanzar este “verde milagroso” en apenas 10 minutos.

¡Logrado!

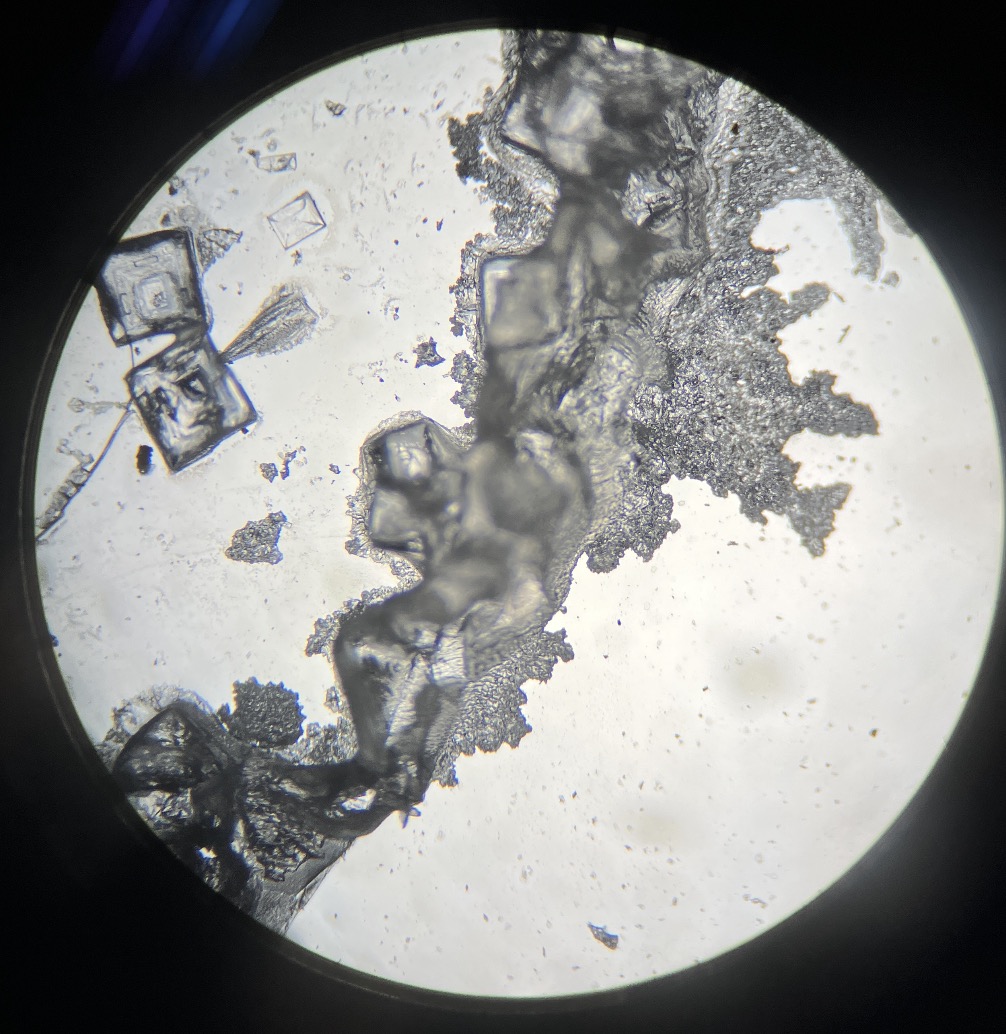
El gran final: observando joyas microscópicas
Una vez lograda la neutralización, toca el paso final. Ponemos una gota de esa solución en un portaobjetos y dejamos que el agua se evapore. Y entonces… ¡sorpresa! En la siguiente clase, al mirar por el microscopio, verán aparecer unos cristales transparentes, cuadrados y bellísimos.
Es muy útil numerar cada portaobjetos para no perder el tuyo.
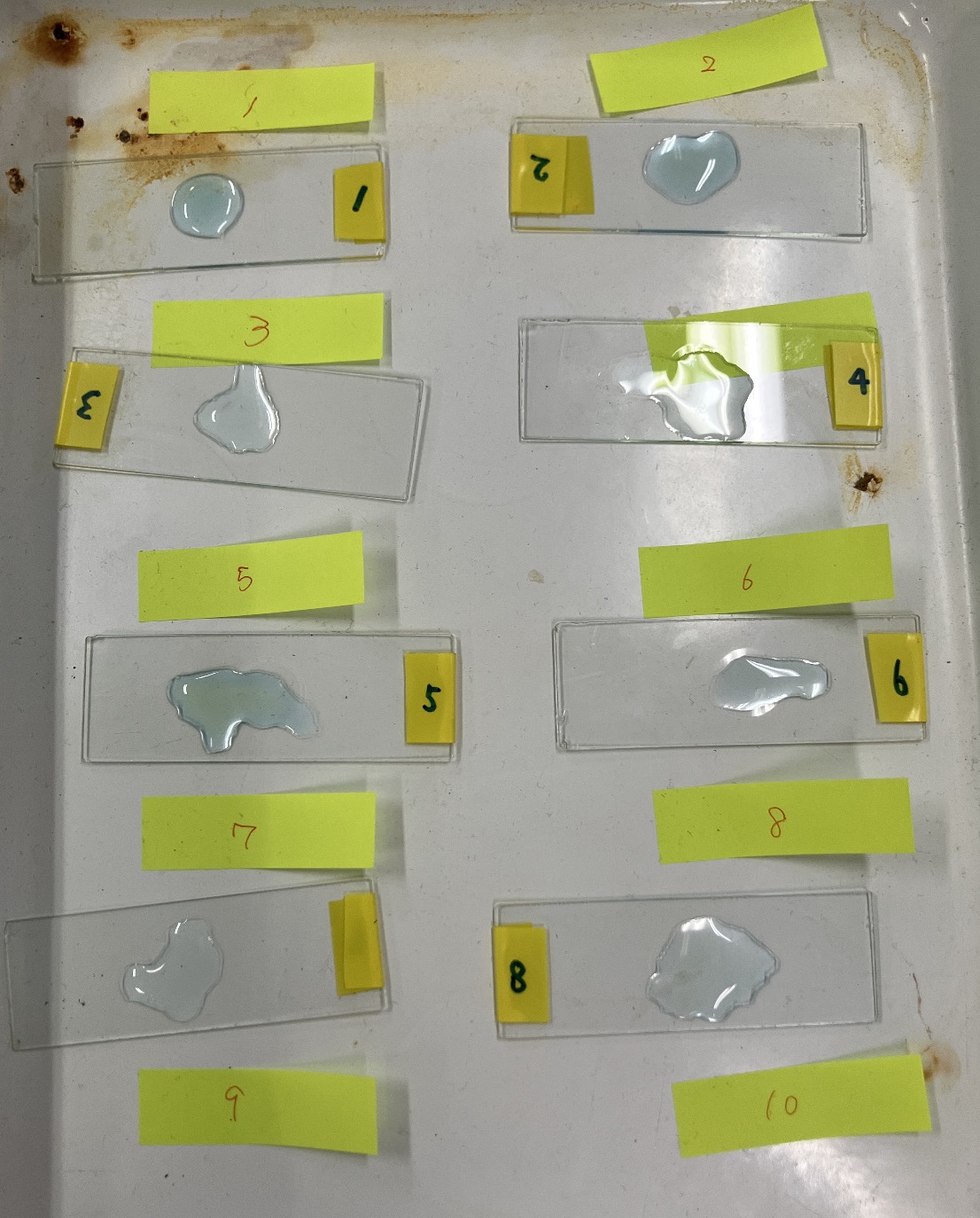
Aunque la observación suele ser en la siguiente sesión, recomiendo tener algunos preparados de antemano para que los alumnos puedan ver el resultado el mismo día.
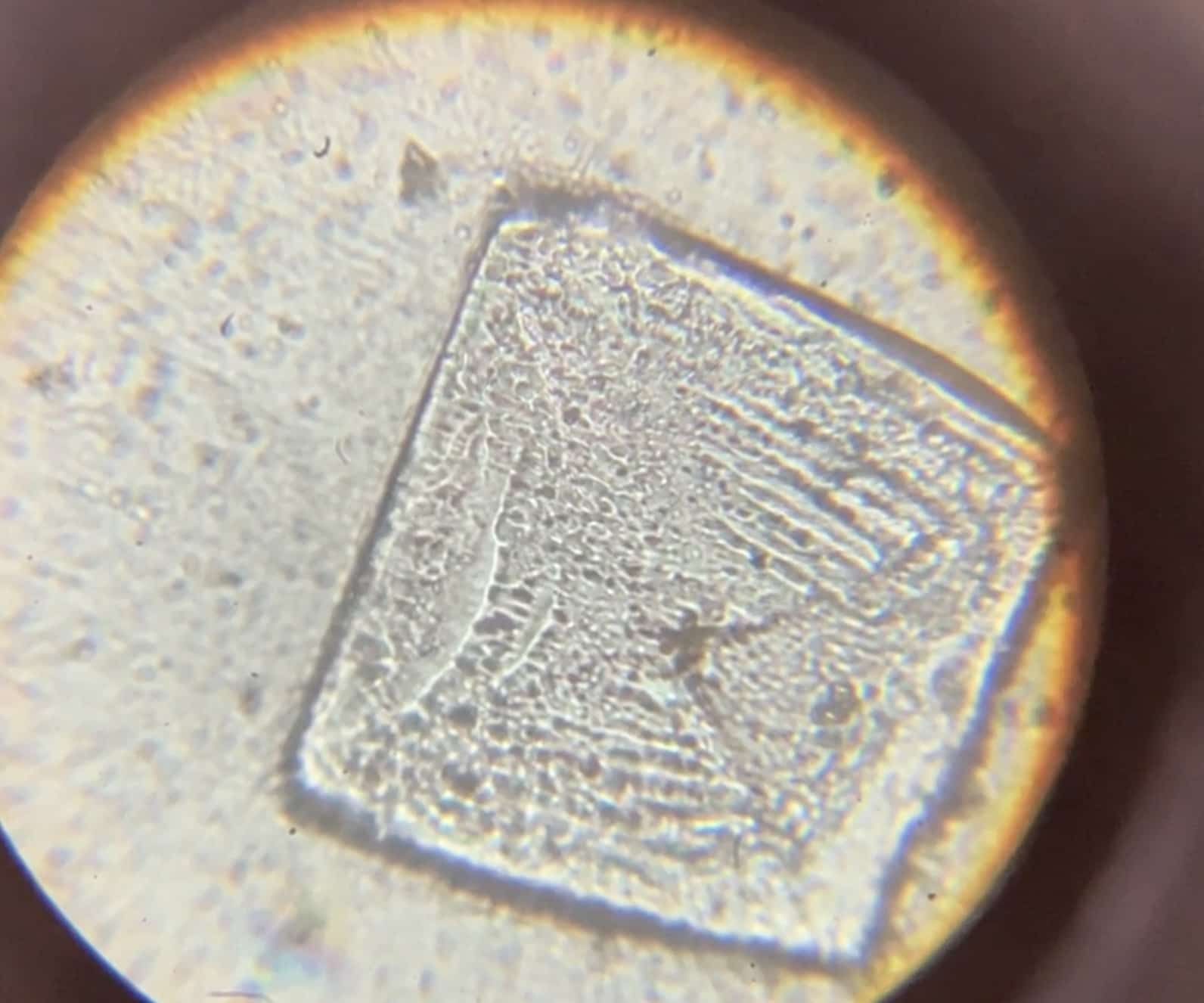
¿Qué son estos cristales? Nada más y nada menos que sal común (cloruro de sodio). Es la prueba de que el ácido y el álcali se unieron para transformarse en algo totalmente nuevo. Esas formas cúbicas tan perfectas parecen auténticas joyas del mundo microscópico.


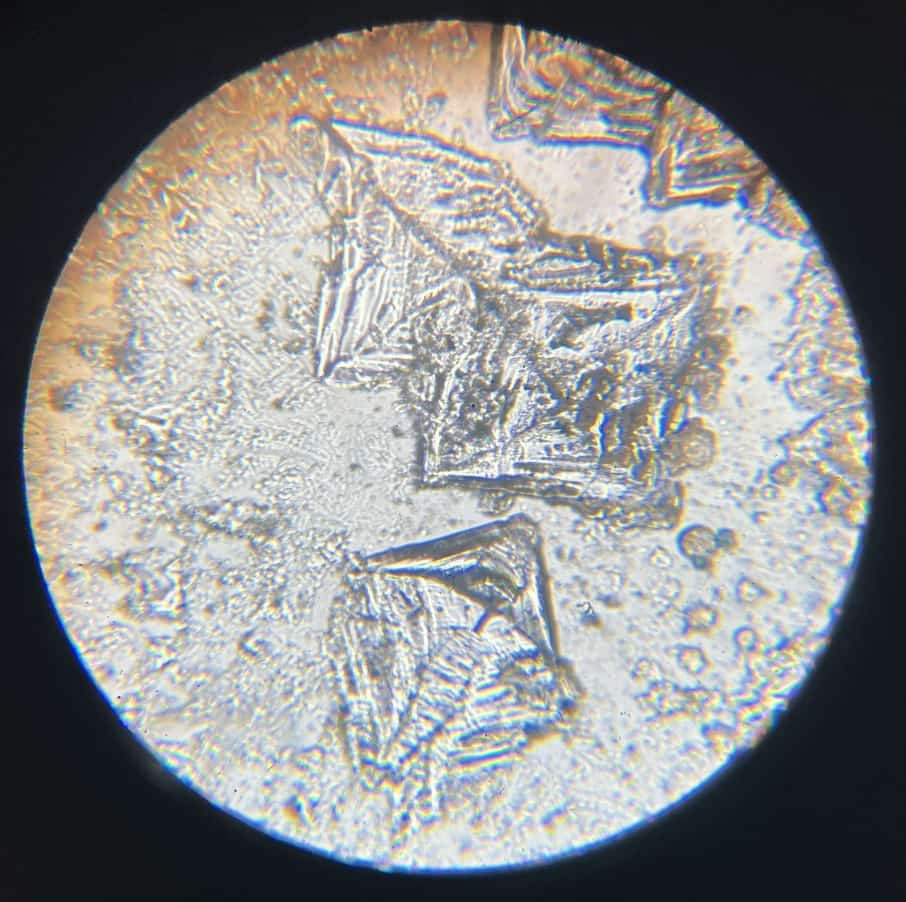
A veces, también se pueden ver cristales en forma de ramas (dendríticos) que suelen ser restos de hidróxido de sodio.
Este experimento permite disfrutar de cambios de color vibrantes, entender el concepto base de la reacción de neutralización y terminar asombrados con los cristales. Aunque prepararlo requiere un poco de maña, ver las caras de sorpresa y descubrimiento de los alumnos hace que, como profesor de ciencias, piense: “¡Valió la pena!”. ¡Espero que ustedes también se animen a probar esta “magia de colores” y sientan la alegría de la ciencia en sus propias manos!
Contacto y Consultas
¡Hagamos que el misterio de la ciencia sea algo cotidiano! Aquí encontrarás experimentos divertidos para hacer en casa y trucos explicados de forma sencilla. ¡Explora todo lo que quieras! ・Mis mejores trucos científicos ahora en libro. Más info aquí. ・Conoce más sobre Ken Kuwako aquí. ・Para colaboraciones (escritura, conferencias, talleres, asesoría en TV, etc.) haz clic aquí. ・¡Sigue las novedades en X (Twitter)!
![]() ¡Vídeos de experimentos en nuestro canal Ciencia en Acción!
¡Vídeos de experimentos en nuestro canal Ciencia en Acción!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。


