Ekologinen, helppo ja siivouskin vaivatonta! Pinoa vain – “hampurilaismallinen Daniellin paristo” -koe
Olen tiedevalmentaja Ken Kuwako. Joka päivä on koe.
 Daniellin pari on keskeinen aihe paristojen ja sähkökemian ymmärtämisessä. Moni opettaja saattaa kuitenkin pähkäillä suuritöisten esivalmisteluiden ja jäteliuosten käsittelyn kanssa.Tässä on ratkaisu: Hampurilais-Daniell-pari! Kuten nimestä voi päätellä, tämä on nerokas ja yksinkertaistettu versio Daniellin parista, jossa materiaalit kerrostetaan päällekkäin aivan kuin hampurilaisessa. Hauskan ulkonäön lisäksi sen suurin etu on ympäristöystävällisyys: jäteliuosta syntyy huomattavasti vähemmän kuin perinteisessä mallissa. Lisäksi se on helppo rakentaa tutuista tarvikkeista, mikä keventää opettajan valmistelutaakkaa merkittävästi.Totta on, että tässä yksinkertaistetussa mallissa liuosten muutoksia ei pääse näkemään yhtä suoraan kuin perinteisessä versiossa. Mutta ei hätää! Yhdistämällä tämän kokeen perinteiseen Daniellin pariin (jota käytetään opettajan havaintoesityksenä), oppilaat pääsevät hyödyntämään molempien mallien parhaat puolet.https://phys-edu.net/wp/?p=41763Havaintoesityksessä voidaan näyttää visuaalisesti ionien liike sekä metallin liukeneminen ja saostuminen. Tämän jälkeen oppilaat pääsevät kokeilemaan sähkön tuottamista itse tällä hampurilaismallilla. Tämä yhdistelmä auttaa oppilaita hahmottamaan perusperiaatteet monesta eri kulmasta. Mikset siis kokeilisi Hampurilais-Daniell-paria omalla tunnillasi? Se on hauska, ekologinen ja saa oppilaat varmasti hihkaisemaan oivaltamisen ilosta!
Daniellin pari on keskeinen aihe paristojen ja sähkökemian ymmärtämisessä. Moni opettaja saattaa kuitenkin pähkäillä suuritöisten esivalmisteluiden ja jäteliuosten käsittelyn kanssa.Tässä on ratkaisu: Hampurilais-Daniell-pari! Kuten nimestä voi päätellä, tämä on nerokas ja yksinkertaistettu versio Daniellin parista, jossa materiaalit kerrostetaan päällekkäin aivan kuin hampurilaisessa. Hauskan ulkonäön lisäksi sen suurin etu on ympäristöystävällisyys: jäteliuosta syntyy huomattavasti vähemmän kuin perinteisessä mallissa. Lisäksi se on helppo rakentaa tutuista tarvikkeista, mikä keventää opettajan valmistelutaakkaa merkittävästi.Totta on, että tässä yksinkertaistetussa mallissa liuosten muutoksia ei pääse näkemään yhtä suoraan kuin perinteisessä versiossa. Mutta ei hätää! Yhdistämällä tämän kokeen perinteiseen Daniellin pariin (jota käytetään opettajan havaintoesityksenä), oppilaat pääsevät hyödyntämään molempien mallien parhaat puolet.https://phys-edu.net/wp/?p=41763Havaintoesityksessä voidaan näyttää visuaalisesti ionien liike sekä metallin liukeneminen ja saostuminen. Tämän jälkeen oppilaat pääsevät kokeilemaan sähkön tuottamista itse tällä hampurilaismallilla. Tämä yhdistelmä auttaa oppilaita hahmottamaan perusperiaatteet monesta eri kulmasta. Mikset siis kokeilisi Hampurilais-Daniell-paria omalla tunnillasi? Se on hauska, ekologinen ja saa oppilaat varmasti hihkaisemaan oivaltamisen ilosta!
Tarvittavat materiaalit ja valmistus
Tämän hampurilaismallin avain on sellofaani. Se toimii erottimena, joka estää eri elektrolyyttiliuosten sekoittumisen mutta päästää ionit läpi – aivan kuten perinteisen mallin huokoinen savilevy tai suolasilta. Yllättävää kyllä, tavallinen askartelukaupoista saatava värillinen sellofaani toimii tässä mainiosti, mikä säästää sekä aikaa että rahaa. Käyttämällä suodatinpaperia (tai jopa talouspaperia) liuosten imeyttämiseen, jätettä syntyy vain nimeksi ja siivoaminen on todella vaivatonta.
Ja usko tai älä, kokeen voi suorittaa jopa tavallisella tulostuspaperilla sellofaanin sijaan. Sinkkisulfaattiliuoksen voi tarvittaessa korvata myös kylläisellä ruokasuolaliuoksella.Valmistelut:
- Sinkkisulfaattiliuos: noin 5 % (liuota 9,8 g sinkkisulfaatti-heptahydraattia 100 grammaan vettä)
- Kuparisulfaattiliuos: noin 17 % (liuota 35,7 g kupari(II)sulfaatti-pentahydraattia 100 grammaan vettä)
- Kaksi pipettiä, kaksi petrimaljaa, sinkkilevy, kuparilevy, kaksi suodatinpaperia (tai talouspaperia), sellofaania, nenäliina, sähkömoottori potkurilla, elektroninen melodiapiiri, yleismittari, hauenleukajohtimet ja pinsetit.

Tässä ovat kaikki tarvittavat välineet.
Kokeen suorittaminen
Sitten on aika koota Hampurilais-Daniell-pari. Vaiheet ovat hyvin yksinkertaiset – ladot vain ainekset päällekkäin kuin tekisit voileipää!Aseta suodatinpaperit petrimaljoihin ja kostuta ne pipetillä; toinen kuparisulfaatilla ja toinen sinkkisulfaatilla. Laita pöydälle nenäliina suojaksi (mieluiten pöydän reunaan) ja aseta sen päälle kuparilevy. Kokoamisjärjestys on seuraava:
Laita pöydälle nenäliina suojaksi (mieluiten pöydän reunaan) ja aseta sen päälle kuparilevy. Kokoamisjärjestys on seuraava: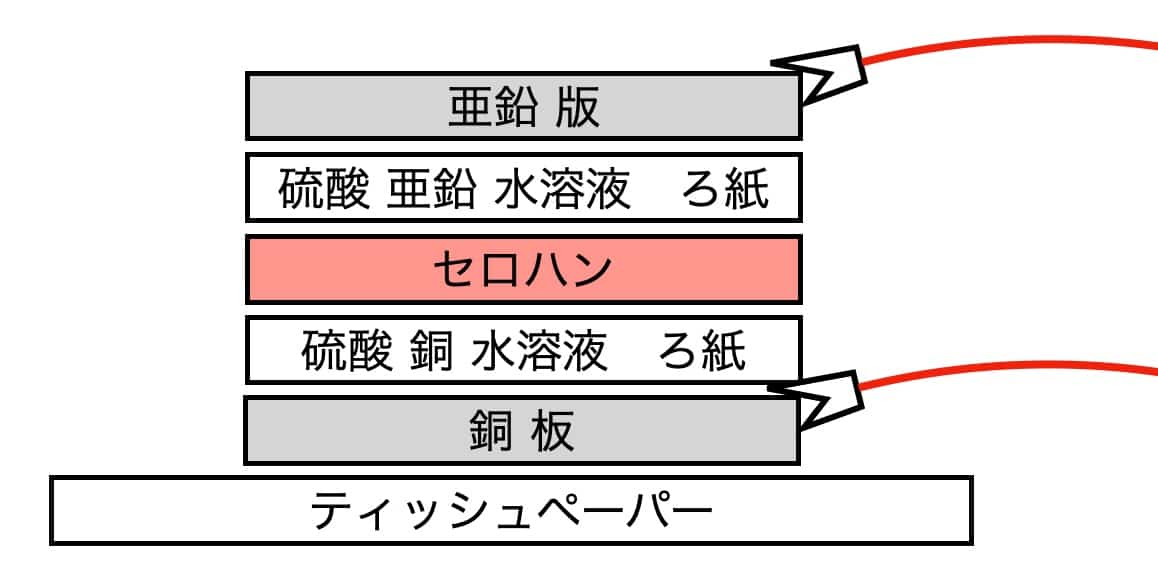
Aseta kuparilevy, sen päälle kuparisulfaatilla kostutettu suodatinpaperi ja sen päälle sellofaani.

Seuraavaksi aseta sinkkisulfaatilla kostutettu suodatinpaperi ja viimeiseksi sinkkilevy. Varmista, etteivät kupari- ja sinkkilevyt kosketa suoraan toisiaan. Kytke sitten hauenleukajohtimet levyihin ja yhdistä ne elektroniseen melodiapiiriin tai moottoriin. Mittaa lopuksi jännite yleismittarilla.https://youtu.be/DA5oORUdbO4
Varmista, etteivät kupari- ja sinkkilevyt kosketa suoraan toisiaan. Kytke sitten hauenleukajohtimet levyihin ja yhdistä ne elektroniseen melodiapiiriin tai moottoriin. Mittaa lopuksi jännite yleismittarilla.https://youtu.be/DA5oORUdbO4
Omassa kokeessani jännite oli noin 1 V. Ihannetapauksessa päästään noin 1,1 volttiin.
3. Jotta virta kulkisi jonkin aikaa, yhdistä johtimet suoraan toisiinsa (oikosulku) ja anna olla noin kaksi minuuttia. Sen jälkeen irrota paperit metallilevyistä ja tarkkaile niiden väriä.
Kuparilevyssä kiinni ollut paperi. Väri on muuttunut punertavaksi.

Sinkkilevyssä kiinni ollut paperi. Jostain syystä tämäkin on muuttunut ruskehtavaksi. Ehkä kupari-ioneja pääsi sellofaanin läpi.
Yksinkertaisesti sanottuna Daniellin pari hyödyntää kahden eri metallin välistä eroa niiden halussa muuttua ioneiksi (eli liukeneda veteen).
Miten Daniellin pari toimii?
Katsotaanpa Daniellin parin tärkeimpiä osia:
- Sinkkilevy (Zn): Toimii negatiivisena napana (miinusnapa).
- Kuparilevy (Cu): Toimii positiivisena napana (plusnapa).
- Sinkkisulfaattiliuos (ZnSO₄): Neste, johon sinkkilevy koskee.
- Kuparisulfaattiliuos (CuSO₄): Neste, johon kuparilevy koskee. Se on väriltään sinistä.
- Sellofaani: Seinä, joka estää liuosten sekoittumisen.
Sähkövirran synty
Sähkövirta on itse asiassa pienten hiukkasten, elektronien, liikettä. Daniellin parissa nämä elektronit pakotetaan liikkeelle metallien välisessä ”kilpailussa”: kumpi metalli haluaa mieluummin muuttua ioniksi ja liukeneda veteen. Tätä kutsutaan sähkökemialliseksi jännitesarjaksi.
- Sinkki (Zn): Haluaa kovasti liukeneda! Se on valmis luovuttamaan elektroneja ($e^-$) muuttuakseen sinkki-ioneiksi ($Zn^{2+}$).
- Kupari (Cu): Ei halua liukeneda yhtä herkästi kuin sinkki. Päinvastoin, liuoksessa olevat kupari-ionit ($Cu^{2+}$) haluavat ottaa vastaan elektroneja ja muuttua takaisin kiinteäksi kupariksi.
Tämä työnjako elektronien luovuttajan (sinkki) ja vastaanottajan (kupari-ionit) välillä on koko pariston toiminnan ydin!
Sähkön reitti askel askeleelta
Miinusnapa (sinkki): Sinkki liukenee ja vapauttaa elektroneja!Sinkkilevyn (Zn) atomit luovuttavat kaksi elektronia ja muuttuvat sinkki-ioneiksi, jotka liukenevat sinkkisulfaattiliuokseen.
Zn → Zn²⁺ + 2e⁻
Tämän seurauksena sinkkilevy syöpyy pikkuhiljaa. Vapautuneet elektronit lähtevät liikkeelle johtoa pitkin kohti kuparilevyä. Tämä on sähkövirtaa!Plusnapa (kupari): Kupari-ionit ottavat elektronit vastaan!Johtoa pitkin tulleet elektronit saapuvat kuparilevylle. Kuparisulfaattiliuoksessa olevat kupari-ionit (jotka tekevät liuoksesta sinisen) rientävät levyn luo ja nappaavat elektronit itselleen.
Cu²⁺ + 2e⁻ → Cu
Kun kupari-ionit saavat elektronit, ne muuttuvat kupariatomeiksi ja saostuvat kuparilevyn pintaan. Kuparilevy siis ”lihoo” ja liuoksen sininen väri haalistuu.
Mikä on sellofaanin tehtävä?
Sellofaani toimii erottimena, joka estää liuoksia sekoittumasta heti kättelyssä. Se ei ole kuitenkaan umpinainen seinä. Koska sinkkipuolella positiiviset ionit lisääntyvät ja kuparipuolella ne vähenevät, sähköinen tasapaino järkkyisi ilman sellofaania. Sellofaanin pienten huokosten kautta negatiiviset ionit pääsevät liikkumaan, mikä pitää pariston toiminnassa.Lue lisää perinteisestä Daniellin parista tästä artikkelista:https://phys-edu.net/wp/?p=41763
Yhteydenotot ja tiedustelut
Tiede on ihmeellistä ja hauskaa, kun sen tuo lähelle arkea! Kerään tänne helppoja ja hauskoja kokeita, joita voit kokeilla kotona. Tutki ja löydä lisää!・Lue lisää Ken Kuwakosta täältä.・Toimeksiannot (kirjoittaminen, luennot, tiedepajat, TV-työt jne.) täältä.・Seuraa päivityksiä X-palvelussa!
![]() Tiedekanavallani julkaisen videoita kokeista!
Tiedekanavallani julkaisen videoita kokeista!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



