Ecológico, sencillo y fácil de limpiar El experimento de la “pila Daniell estilo hamburguesa” que solo se apila
Soy Ken Kuwako, entrenador científico. Para mí, cada día es un experimento.
 La pila de Daniell es un tema fundamental para comprender el funcionamiento de las baterías, ¿verdad? Sin embargo, sé que muchos profesores se enfrentan a dificultades por lo laborioso de su preparación y la gestión de los residuos químicos.Por eso, hoy quiero presentarles la ¡Pila Daniell tipo hamburguesa! Como su nombre indica, es una versión simplificada y revolucionaria que se construye apilando materiales como si fuera un sándwich. Lo mejor no es solo lo ingenioso de su nombre, sino que reduce drásticamente la cantidad de residuos líquidos, siendo mucho más respetuosa con el medio ambiente. Además, al usar materiales cotidianos, la carga de preparación para la clase disminuye notablemente.Es cierto que, al ser una versión compacta, no se puede observar directamente el comportamiento de las soluciones. ¡Pero no se preocupen! Si combinan este experimento con una pila de Daniell convencional (para demostración), podrán aprovechar las ventajas de ambas y profundizar el aprendizaje de sus alumnos.https://phys-edu.net/wp/?p=41763Por ejemplo, pueden usar la pila convencional para mostrar visualmente el movimiento de los iones y la disolución o depósito de los metales, y luego permitir que los alumnos experimenten la generación de energía de forma práctica y sencilla con el método de la hamburguesa. Con este enfoque combinado, los estudiantes captarán los principios básicos desde múltiples ángulos. ¿Se animan a probar esta actividad divertida y ecológica en su próxima clase de química?Shutterstock
La pila de Daniell es un tema fundamental para comprender el funcionamiento de las baterías, ¿verdad? Sin embargo, sé que muchos profesores se enfrentan a dificultades por lo laborioso de su preparación y la gestión de los residuos químicos.Por eso, hoy quiero presentarles la ¡Pila Daniell tipo hamburguesa! Como su nombre indica, es una versión simplificada y revolucionaria que se construye apilando materiales como si fuera un sándwich. Lo mejor no es solo lo ingenioso de su nombre, sino que reduce drásticamente la cantidad de residuos líquidos, siendo mucho más respetuosa con el medio ambiente. Además, al usar materiales cotidianos, la carga de preparación para la clase disminuye notablemente.Es cierto que, al ser una versión compacta, no se puede observar directamente el comportamiento de las soluciones. ¡Pero no se preocupen! Si combinan este experimento con una pila de Daniell convencional (para demostración), podrán aprovechar las ventajas de ambas y profundizar el aprendizaje de sus alumnos.https://phys-edu.net/wp/?p=41763Por ejemplo, pueden usar la pila convencional para mostrar visualmente el movimiento de los iones y la disolución o depósito de los metales, y luego permitir que los alumnos experimenten la generación de energía de forma práctica y sencilla con el método de la hamburguesa. Con este enfoque combinado, los estudiantes captarán los principios básicos desde múltiples ángulos. ¿Se animan a probar esta actividad divertida y ecológica en su próxima clase de química?Shutterstock
Materiales necesarios y cómo prepararlos
La pieza clave de esta pila Daniell tipo hamburguesa es el celofán. Al igual que la placa de cerámica porosa o el puente salino en una pila estándar, actúa como una barrera que permite el paso de los iones pero evita que las soluciones se mezclen por completo. Sorprendentemente, el papel celofán de colores que venden en cualquier papelería funciona de maravilla, lo que reduce costos y tiempo. Además, al usar papel de filtro (o incluso papel de cocina) como soporte para las soluciones, apenas se generan desperdicios líquidos, facilitando mucho la limpieza posterior.
Un dato curioso: me han comentado que incluso se puede realizar usando papel común de fotocopiadora en lugar de celofán, y que la solución de sulfato de zinc puede sustituirse por una solución saturada de sal común.【Qué preparar】
- Solución de sulfato de zinc: aprox. 5% (disolver 9.8 g de sulfato de zinc heptahidratado en 100 g de agua).
- Solución de sulfato de cobre: aprox. 17% (disolver 35.7 g de sulfato de cobre (II) pentahidratado en 100 g de agua).
- 2 goteros, 2 placas de Petri, una lámina de zinc, una lámina de cobre, 2 trozos de papel de filtro (o papel de cocina), 1 trozo de celofán, un pañuelo de papel, un motor con hélice, una tarjeta musical electrónica, un multímetro, cables con pinzas de cocodrilo y pinzas.

Aquí tenemos todo el material listo.
Método experimental
¡Es hora de armar nuestra pila hamburguesa! El proceso es sencillísimo: solo hay que ir colocando los ingredientes uno sobre otro.Coloca los papeles de filtro en las placas de Petri y empúpalos bien usando los goteros: uno con sulfato de cobre y el otro con sulfato de zinc. Pon un pañuelo de papel sobre la mesa y coloca la lámina de cobre encima. El orden de las capas es el siguiente:
Pon un pañuelo de papel sobre la mesa y coloca la lámina de cobre encima. El orden de las capas es el siguiente: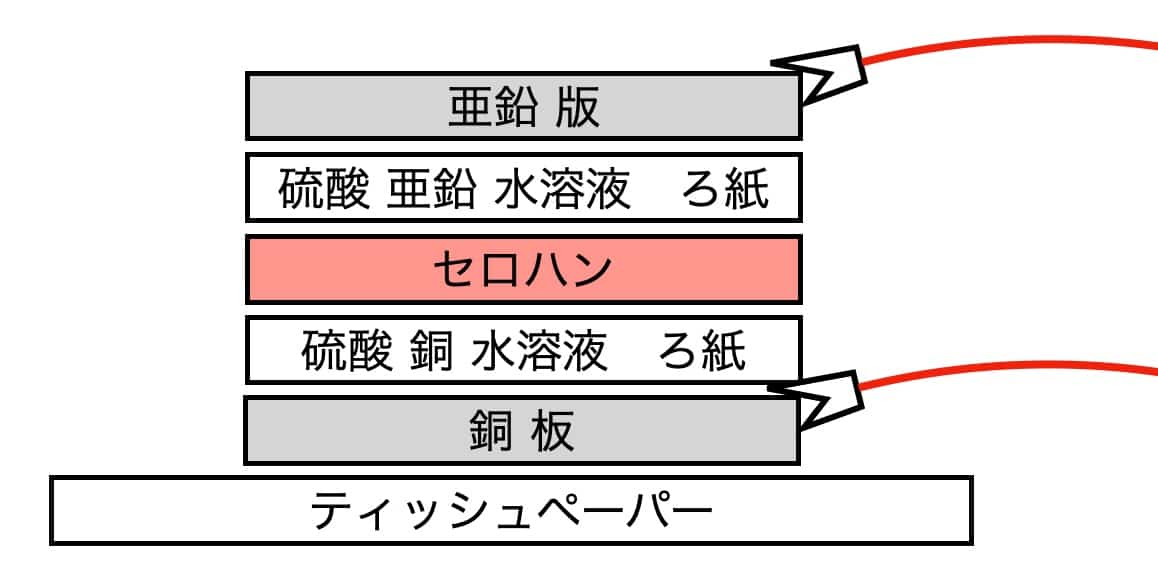
Lámina de cobre -> Papel con sulfato de cobre -> Celofán.

Luego, añade el papel con sulfato de zinc y, finalmente, la lámina de zinc en la cima. Es vital asegurarse de que la lámina de cobre y la de zinc no se toquen directamente. Conecta las pinzas de cocodrilo a los terminales y únelas al motor o a la tarjeta musical. Luego, mide el voltaje con el multímetro.https://youtu.be/DA5oORUdbO4
Es vital asegurarse de que la lámina de cobre y la de zinc no se toquen directamente. Conecta las pinzas de cocodrilo a los terminales y únelas al motor o a la tarjeta musical. Luego, mide el voltaje con el multímetro.https://youtu.be/DA5oORUdbO4
En mi prueba, obtuve cerca de 1 V. ¡Lo ideal es llegar a los 1.1 V!
Para ver cambios claros, deja que la corriente fluya un rato (puedes crear un cortocircuito uniendo los cables directamente) durante unos 2 minutos. Luego, retira los papeles de las placas metálicas y observa los cambios de color.
El papel de la lámina de cobre se vuelve más rojizo.

Curiosamente, el papel del zinc también mostró tonos marrones. ¿Habrán cruzado los iones de cobre a través del celofán?
En resumen, la pila de Daniell aprovecha la diferencia en la tendencia de dos metales a convertirse en iones para generar electricidad.
¿Cómo funciona la pila de Daniell?
Repasemos los componentes principales:
- Lámina de Zinc (Zn): Actúa como el polo negativo (–).
- Lámina de Cobre (Cu): Actúa como el polo positivo (+).
- Sulfato de Zinc (ZnSO₄): El líquido donde reside el zinc.
- Sulfato de Cobre (CuSO₄): El líquido donde reside el cobre (es de color azul).
- Celofán: La barrera que evita que los líquidos se mezclen de golpe.
El secreto de la corriente
La electricidad es, en esencia, el movimiento de minúsculas partículas llamadas electrones. En esta pila, se produce una “competencia” basada en qué metal tiene más ganas de disolverse en el agua (esto se conoce como serie electroquímica o tendencia de ionización).
- Zinc (Zn): ¡Tiene muchas ganas de disolverse! Prefiere soltar electrones ($e^-$) para convertirse en ion ($Zn^{2+}$).
- Cobre (Cu): No tiene tantas ganas. De hecho, los iones de cobre ($Cu^{2+}$) de la solución prefieren recibir electrones para volver a ser cobre sólido.
¡Esa transferencia de electrones entre el zinc que quiere darlos y el cobre que quiere recibirlos es lo que hace funcionar la pila!
El proceso paso a paso
- 【Polo Negativo: El Zinc se disuelve】
El zinc metálico suelta dos electrones y se transforma en ion zinc, pasando a la solución.
Zn → Zn²⁺ + 2e⁻ (Libera electrones)
Como resultado, la lámina de zinc se va desgastando. Esos electrones viajan por el cable hacia el cobre. ¡Ese flujo es la corriente eléctrica!
- 【Polo Positivo: El Cobre recibe los electrones】
Cuando los electrones llegan a la lámina de cobre, los iones de cobre ($Cu^{2+}$) que daban el color azul a la solución los atrapan de inmediato.
Cu²⁺ + 2e⁻ → Cu (Recibe electrones)
Al recibir los electrones, los iones vuelven a ser cobre sólido y se pegan a la lámina, haciéndola “engordar”. Por eso, el color azul de la solución se va aclarando.
¿Para qué sirve el celofán?
No es solo un muro. Mientras el lado del zinc se llena de cargas positivas ($Zn^{2+}$) y el del cobre las pierde, el celofán permite que otros iones (como el $SO_4^{2-}$) se muevan por sus poros microscópicos para mantener el equilibrio eléctrico. Sin este intercambio, la pila dejaría de funcionar en segundos.Para saber más sobre la versión estándar, no te pierdas este artículo:https://phys-edu.net/wp/?p=41763
Contacto y solicitudes
¡Hagamos que la ciencia sea algo cercano y fascinante! Aquí comparto experimentos sencillos para hacer en casa y consejos prácticos.・Sobre el autor, Ken Kuwako: clic aquí・Para conferencias, talleres o consultoría televisiva: clic aquí・¡Sígueme en X (Twitter) para novedades!
![]() ¡Mira mis experimentos en el canal Science Material Channel!
¡Mira mis experimentos en el canal Science Material Channel!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



