Metallien tuolileikki! “Haluan olla ioni!” Mikroskaalan koe metallien reaktiivisuudesta
Tässä on Kensaku Kuwako, tiedekouluttajanne. Jokainen päivä on kokeilu!
Miksi rautanaula ruostuu, mutta kultasormus säilyttää hohtonsa ikuisesti? Miksi paristot tuottavat sähköä vain tiettyjen metalliyhdistelmien avulla? Salaisuus piilee siinä, kuinka vahvasti metallit haluavat ”muuttua ioneiksi!”, eli niiden ”kyvyssä muuttua metalli-ioneiksi”.
Tänään esittelen teille ympäristöystävällisen, mikromittakaavassa (ultrapienellä skaalalla) suoritettavan kokeen, jolla paljastetaan tämä näkymätön metallien ”tosi aie”. Avainsanat ovat ”pienet kemikaalimäärät, havaittavuus ja turvallisuus”. Parasta on, että koe on helppo toteuttaa, jopa yläasteikäisille, ja vaatii vain vähän esivalmisteluja. Olitpa sitten kemian ystävä tai hieman epäilevä, värien muutos saa sinut varmasti innostumaan!
”Metallin muuttuminen ioniksi vesiliuoksessa” saattaa kuulostaa hankalalta, mutta kun näet dramaattiset muutokset, kuten metallin värin muuttumisen tai liuoksen sinisen värin katoamisen, ymmärrät heti: ”Ahaa, tätä se tarkoittaa!” Lisäksi käyttämällä mikrolevyä ja pikkupulloja jätteen määrä vähenee dramaattisesti, minimoiden kokeen ympäristövaikutukset.
Tässä artikkelissa käymme läpi yksityiskohtaisesti kokeen valmistelut, havainnot ja pohdinnan siitä, ”miksi näin tapahtuu”.
Tarvikkeet
Työkalu / Kemikaali | Kuvaus — | — Kupari-, sinkki- ja magnesiumlevyt | Kokeen päätähdet, kolme metalli”pelaajaa”
- 3 % kuparisulfaattiliuos | Kupari-ioni (sininen)
- 3 % sinkkisulfaattiliuos | Sinkki-ioni (väritön)
- 3 % magnesiumsulfaattiliuos | Magnesium-ioni (väritön)
 💡 Suositeltu tuote: Narikan pienet pullot (täältä) helpottavat annostelua pisara kerrallaan ja niiden käyttötuntuma on täysin eri luokkaa kuin euron pullojen.
💡 Suositeltu tuote: Narikan pienet pullot (täältä) helpottavat annostelua pisara kerrallaan ja niiden käyttötuntuma on täysin eri luokkaa kuin euron pullojen.

https://www.rika.com/product/detailed/S75-1140-02
Muita tarvittavia välineitä ovat mikrolevy (jossa reaktioita voi tarkkailla pienellä määrällä), pinsetit ja suojalasit.
Kemikaalien valmistelu (3 % liuoksen ohje)
Tässä ohjeet liuosten valmistukseen. Nämä ovat hieman teknisempiä muistiinpanoja opettajille.
3 % kuparisulfaattiliuoksen valmistus: Liuota kuparisulfaatti(II) pentahydraatti (CuSO4・5H20) 4,9 g + 100 g vettä.
3 % sinkkisulfaattiliuoksen valmistus: Liuota sinkkisulfaatti heptahydraatti (ZnS04・7H20) 5,6 g + 100 g vettä.
3 % magnesiumsulfaattiliuoksen valmistus: Liuota magnesiumsulfaatti heptahydraatti (MgSO4・7H20) 6,5 g + 100 g vettä.
Kokeen vaiheet
Metallilevyjen valmistelu
Hio jokainen metallilevy kevyesti, kunnes pinta kiiltää. Tällä poistetaan pinnalla oleva hapettunut kerros (ruoste tms.) ja paljastetaan metallin ”oikeat kasvot”. Reaktio tapahtuu näin huomattavasti helpommin!
Metallin asettelu mikrolevylle
Aseta kolme erilaista metallinpalaa mikrolevyn jokaiseen kuoppaan (soluun). (Käytämme 9 kuoppaa, jotta saamme kokeiltua kaikki 3 metallia × 3 liuosta -yhdistelmät).
Lisää liuokset tiputtamallaPikkupulloilla lisätään noin 3 tippaa kutakin liuosta kuhunkin metalliin. Tarkkaile reaktiotaKiinnitä huomiota kolmeen seikkaan: värin muutokseen, kuplien muodostumiseen ja metallin pinnan ulkonäköön.
Kokeen tulokset ja havaintoesimerkit
Tässä on kokeen todelliset tulokset.
Tässä näkymä mikrolevystä. Kaikista yhdeksästä yhdistelmästä havaittiin selvät reaktiot joissakin kuopissa (kuten kuvassa vasemmassa alakulmassa olevat kolme kuoppaa).

Erityisen dramaattiset olivat ne metallit, jotka laitettiin siniseen kuparisulfaattiliuokseen.
【Kuparisulfaattiliuos × Magnesiumlevy】
 Vasen: ennen reaktiota, Oikea: reaktion jälkeen
Vasen: ennen reaktiota, Oikea: reaktion jälkeen

Magnesiumpala on hieman ohentunut (se on liuennut).

Oikealla uusi, vasemmalla reaktion jälkeen. Pinta on mustunut.
Kun magnesium lisätään, pinta muuttuu nopeasti mustahkoksi ja sinisen liuoksen väri alkaa haalistua! Myös itse magnesiumlevy on hieman liuennut (ohentunut).
【Kuparisulfaattiliuos × Sinkkilevy】
 Vasen: ennen reaktiota, Oikea: reaktion jälkeen
Vasen: ennen reaktiota, Oikea: reaktion jälkeen Myös sinkkilevyn pintaan ilmestyi punertavaa sakkaa. Reaktiot eivät olleet yhtä rajuja kuin magnesiumin kanssa, mutta selvä muutos tapahtui.
Myös sinkkilevyn pintaan ilmestyi punertavaa sakkaa. Reaktiot eivät olleet yhtä rajuja kuin magnesiumin kanssa, mutta selvä muutos tapahtui.
【Kuparisulfaattiliuos × Kuparilevy】
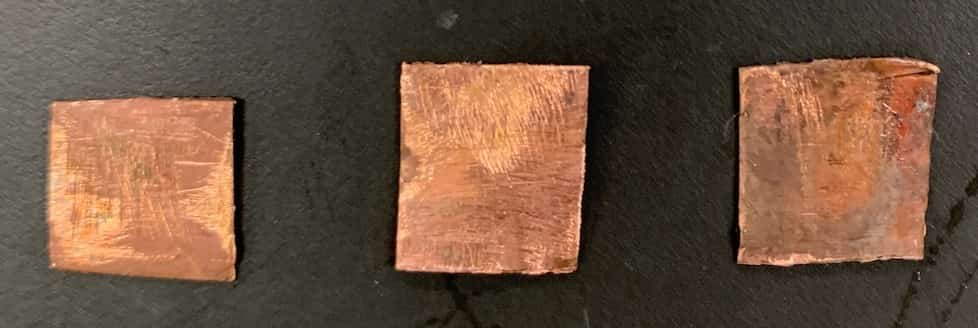 Kuparilevyssä ei tapahtunut lainkaan muutosta, vaikka se laitettiin kuparisulfaattiliuokseen.
Kuparilevyssä ei tapahtunut lainkaan muutosta, vaikka se laitettiin kuparisulfaattiliuokseen.
Yhteenvetona, havaitut muutokset yhdistelmittäin olivat:
Kuparisulfaatti × Magnesium | Metallin pinta mustuu, saostumaa ilmestyy Kuparisulfaatti × Sinkki | Metallin pintaan punertavaa sakkaa Kuparisulfaatti × Kupari | Ei muutosta
Pohdinta: Metallin ionisoitumisherkkyys (Jännitesarja)
Näiden reaktiotulosten perusteella voidaan johtaa järjestys sille, kuinka helposti metalli vapauttaa elektroneja ja muuttuu ioniksi (= jännitesarja).
Magnesium > Sinkki > Kupari
Magnesium reagoi kaikkein aktiivisimmin, kun taas kuparissa ei tapahdu mitään muutosta. Tämä osoittaa, että magnesium vapauttaa elektroneja helposti ja ionisoituu erittäin herkästi.
Yhteenveto ja vinkkejä opetukseen
Mikromittakaavan koe, jossa yhdistyvät tilaa säästävä, edullinen ja turvallinen toteutus. Värimuutokset ovat dramaattisia – ”sininen väri katoaa”, ”punainen metalli ilmestyy” – mikä tekee kemiallisen muutoksen ymmärtämisestä helppoa. Pohdintaprosessi muodostaa ”miksi?”-kysymystä selvittävän tarinan, ja se sopii erinomaisesti ryhmätyöskentelyyn. Jätettä syntyy vain muutamia tippoja mikrolevyn kuopissa, joten siivoaminen on helppoa ja ympäristöystävällistä!
Ionisoitumisherkkyyden ymmärtäminen on erittäin tärkeä perusta, joka liittyy yläasteen tieteissä opiskeltavaan ”Daniellin paristoon” (laite, joka tuottaa sähköä sinkin ja kuparin ionisoitumisherkkyyden eron avulla) ja lukion kemian ”metallin korroosioon (ruoste)”.
Tule ja tutkitaan kemian kiehtovaa maailmaa tämän hauskan kokeen avulla!
Mikromittakaavan kokeet amazon
Yhteydenotot ja tiedustelut
Tuo tieteen ihmeet ja hauskuus lähemmäksi! Olen koonnut selkeästi hauskoja kotona tehtäviä kokeita ja niiden vinkkejä. Selaa ja etsi lisää!・Tietoa ylläpitäjästä, Kensaku Kuwakosta tästä・Erilaiset tiedustelut (kirjoittaminen, luennot, tiedekerhot, TV-konsultointi/esiintymiset jne.) tästä・Artikkelipäivitykset lähetetään X-palvelussa!
![]() Tiedevinkit-kanavalla julkaistaan kokeellisia videoita!
Tiedevinkit-kanavalla julkaistaan kokeellisia videoita!


