¿Hervir sin calor? ¡Un experimento sorprendente de “ebullición por descompresión” con una sola jeringa! (Cambio de estado)
¡Hola! Soy Ken Kuwako, instructor de ciencias. Para mí, cada día es un experimento.
“El agua solo hierve cuando llega a los 100 grados”… ¿Alguna vez has dado esto por sentado? Pues te sorprenderá saber que existe un método casi mágico para hacer que el agua tibia burbujee al instante sin usar ni una pizca de fuego.
Hoy quiero presentarte el fascinante experimento de ebullición por reducción de presión, algo que puedes probar tú mismo usando simplemente una jeringuilla. Vamos a observar cómo los cambios de estado, que a veces parecen solo teoría de libros de texto, se transforman de forma dinámica ante nuestros ojos.
La jeringuilla mágica: cómo hacer hervir el agua sin calentarla
En las clases de ciencias aprendemos que el agua cambia de estado (de hielo a líquido o a vapor) según la temperatura. Sin embargo, también es posible alterar drásticamente el estado de la materia cambiando la presión. Este experimento, sencillo pero revelador, me lo enseñó el profesor Y, a quien siempre agradezco sus grandes ideas.
【Qué necesitas】 ・Una jeringuilla (sin aguja) ・Agua caliente (a unos 70 grados centígrados)
【Pasos del experimento】
Primero, prepara un poco de agua a unos 70 grados en un recipiente.
Succiona una pequeña cantidad de agua con la jeringuilla. El truco está en dejar bastante espacio libre para poder tirar del émbolo después.
Tapa con fuerza la punta de la jeringuilla con el dedo pulgar para que quede sellada herméticamente y no entre aire.
Ahora, tira del émbolo con fuerza para reducir la presión en el interior.

¡Mira lo que pasa! Aunque no has subido la temperatura, el agua empezará a hervir con fuerza de repente.

Lo más curioso es que, en cuanto sueltas el émbolo y vuelve a su posición original, el hervor se detiene al instante. Esto nos demuestra claramente que la causa de la ebullición en este caso no es la temperatura, sino el cambio de presión.
¿Por qué el arroz no se cocina bien en la cima de una montaña?
¿Por qué el agua hierve al bajar la presión?
El agua se mantiene en estado líquido porque el peso del aire que nos rodea (la presión atmosférica) presiona las moléculas de agua desde arriba, evitando que “escapen”. Normalmente, a nivel del mar, las moléculas de agua no tienen la fuerza suficiente para vencer esa presión hasta que alcanzan los 100 grados. Sin embargo, al crear un vacío parcial dentro de la jeringuilla, la fuerza que retiene a las moléculas se debilita. Como resultado, las moléculas pueden escapar libremente incluso a temperaturas bajas, iniciando la ebullición.
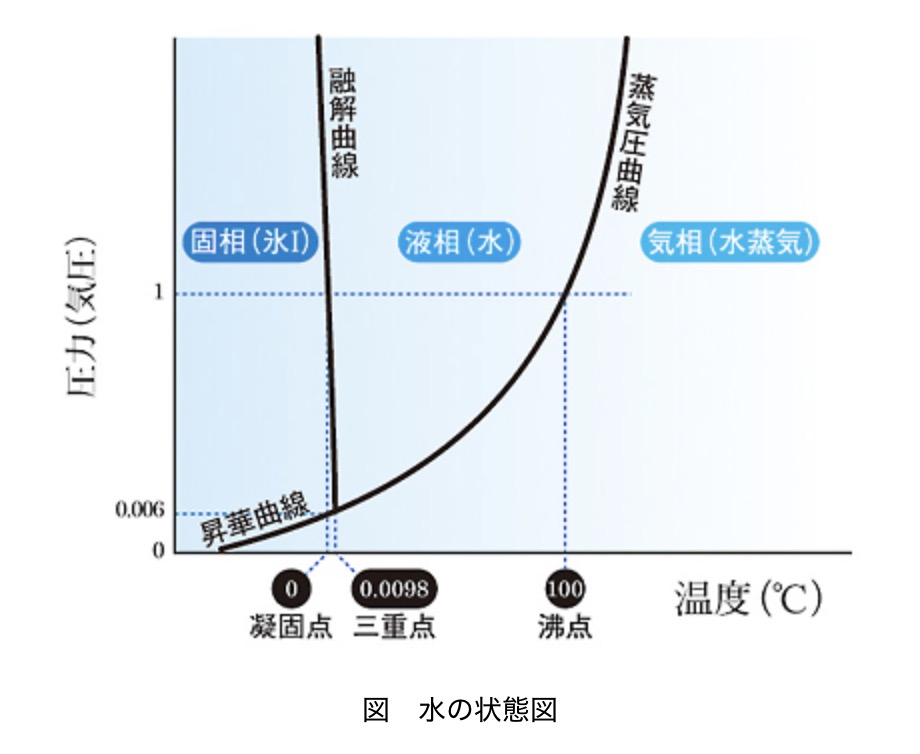
Fuente: Rika Nenpyo “Explícame los estados sólido, líquido y gaseoso.” https://official.rikanenpyo.jp/posts/6660
Este principio está muy presente en nuestra vida diaria. Por ejemplo, en lugares altos como la cima del Monte Fuji (3776 m), la presión es mucho menor (unos 630-640 hPa, casi dos tercios de la presión al nivel del mar). Allí, el agua hierve a unos 80 o 90 grados. Por eso, si intentas cocinar arroz en una olla común en la montaña, es probable que se quede duro por dentro.
Seguro que has notado que las bolsas de snacks se inflan cuando subes a lugares elevados.

Poder recrear en casa el mismo ambiente que en la cima de una gran montaña usando solo una jeringuilla es la verdadera magia de la ciencia. ¡Te invito a que pruebes con distintas temperaturas y veas hasta qué punto puedes hacer hervir el agua tibia!
Contacto y colaboraciones
¡Hagamos que la ciencia sea más divertida y cercana! En este blog comparto experimentos sencillos que puedes hacer en casa y consejos fáciles de entender. ¡Echa un vistazo a otros artículos! ・El contenido de mis apuntes científicos se ha convertido en libro. Más detalles aquí. ・Conoce más sobre Ken Kuwako aquí. ・Para solicitudes de colaboración (escritura, conferencias, talleres, asesoría en TV, etc.), haz clic aquí. ・¡Sigue las actualizaciones en X (Twitter)!
![]() ¡Mira los vídeos de los experimentos en nuestro canal Ciencia en Acción!
¡Mira los vídeos de los experimentos en nuestro canal Ciencia en Acción!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



