Näin laimennat suolahapon, rikkihapon, ammoniakin ja kuparikloridin – opi laimennuksen perusteet ja valmistaudu turvallisiin oppitunteihin!
Hei, olen tiedekouluttaja Ken Kuwako. Joka päivä on kokeilu.

【Lue tämä artikkeli englanniksi】
Kun käsittelet kemikaaleja laboratoriossa, laimentamisen perusteet ovat ehdottoman tärkeitä, jotta kokeilut sujuvat turvallisesti, tarkasti ja tehokkaasti. Tähän artikkeliin kokosin opettajille tärkeimmät vinkit kemikaalien laimentamiseen, turvallisuusohjeisiin ja oikeisiin pitoisuuksiin käytännön kokeissa. Nämä tiedot keräsin alun perin itseäni varten, mutta ne ovat todellinen pelastus arjessa. Hyvä valmistelu luo mielenrauhaa ja takaa onnistuneet tunnit. Tämän artikkelin luettuasi hallitset yleisimpien kemikaalien laimentamisen kuin ammattilainen.
Esimerkiksi Hamashima Shotenin tiedeoppaan (s. 243) kaltaisissa kirjoissa on hyviä ohjeita laimentamisesta. Natriumhydroksidin elektrolyysissä 5 % pitoisuus on riittävä, samoin kuin suolahapon elektrolyysissä. Tässä artikkelissa käyn tarkemmin läpi, miten liuoksia valmistetaan, ja jaan vinkkejä opettajien tarpeisiin. Laskelmat, kuten massa-%:n muuntaminen molaarisuudeksi, on käsitelty erillisessä artikkelissa. Tutustu siihen täällä:
Suolahapon laimentaminen
Peruskoulun tiedetunneilla käytettävää suolahappoa kannattaa laimentaa kerralla vahvasta suolahaposta. Jotta saat 10 % suolahappoa, lisää 3,2 osaa vettä yhteen osaan vahvaa suolahappoa. Esimerkiksi jos haluat laimentaa koko 500 cm³ pullollisen, lisää 1600 cm³ vettä. 3 litran muovikanisteri (amazon) on kätevä laimentamista ja säilytystä varten.

|
|
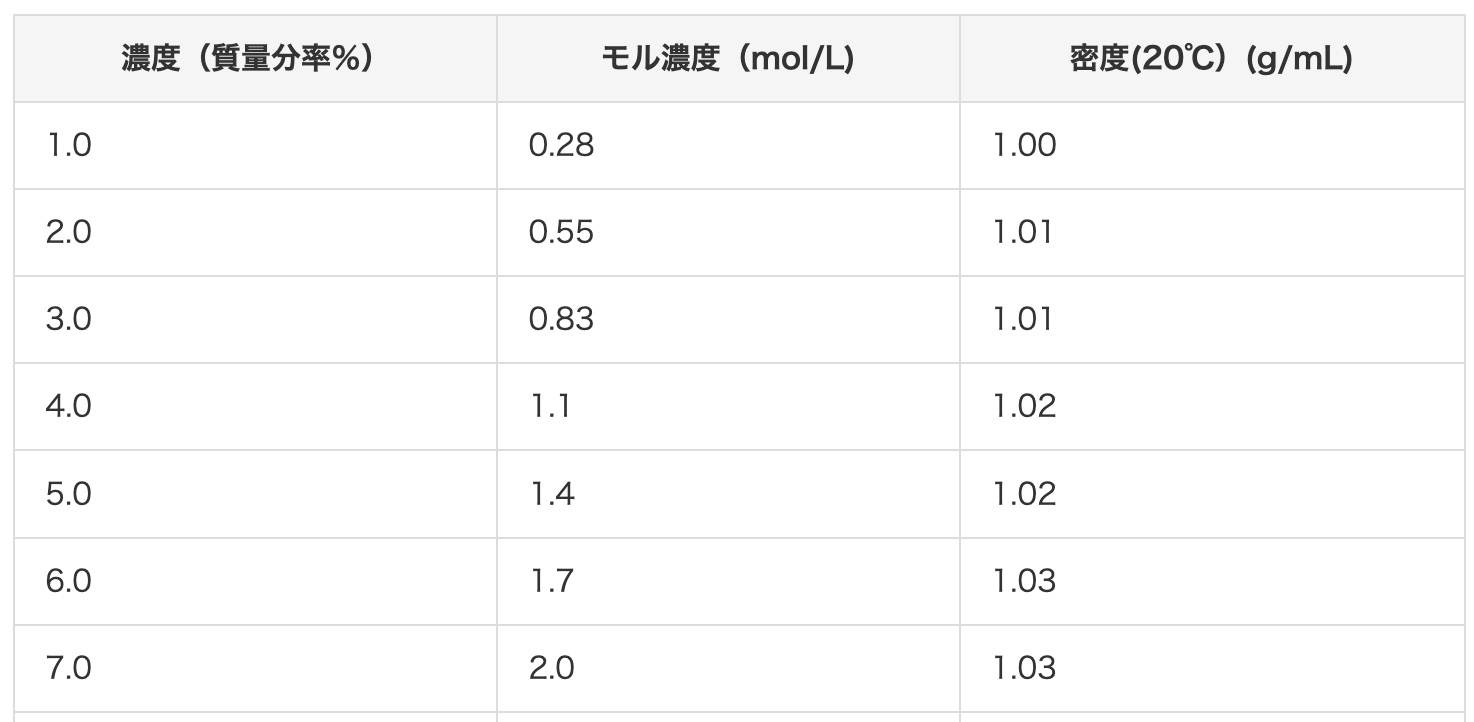
Voit käyttää myös tämän sivuston suolahapon pitoisuuden muuntotaulukkoa apunasi.
Täältä löydät myös videon laimentamisesta:
Jos epäilet, tarkista laskelmat.
Vahvan suolahapon pitoisuus on 12 mol/L ja tiheys 1,18 g/mL. Esimerkiksi 1 litran (1000 ml) vahvan suolahapon liuos painaa:
1.18×1000=1180g
Ja liuenneen aineen massa, kun molekyylimassa on 36,5, on:
12×36.5=438g
Siksi vahvan suolahapon massaprosenttipitoisuus on:
438/1180=37.1%
Jotta tämä pitoisuus saadaan 10 %:iin, lisättävän veden määrä [g] on x. Silloin:
438/(1180+x)=10/100
x=3200g
Tämä tarkoittaa, että lisäämällä 3,2 litraa vettä yhteen litraan suolahappoa saadaan 10 % pitoisuus. Jos sinulla on 500 ml suolahappoa, tarvitset puolet, eli 1,6 litraa vettä.
Tärkeä huomautus:
Kun laimennat suolahappoa, muista aina lisätä happo veteen, ei koskaan toisin päin! Kun happoon tai emäkseen lisätään vettä, liukenemisreaktio voi vapauttaa lämpöä, jolloin vesi voi roiskua vaarallisesti. Alla on lisätietoja suolahapon ja rikkihapon laimentamisesta. Vahvan suolahapon ja rikkihapon pitoisuuserot johtuvat niiden erilaisesta liukoisuudesta.

Pitoisuus 9 %:n tapauksessa normaalisuus N on noin 2,6 (2,6 mol/L)
Pitoisuus 4 %:n tapauksessa normaalisuus N on noin 1 (1 mol/L)
Lähde: http://www.keins.city.kawasaki.jp/9/ke9004/benrihp060821/2020.benrichou.ensan.pdf
Vahvan suolahapon pitoisuus on 12 mol/L. Joten, jotta saat 1 mol/L pitoisuuden, sinun on laimennettava se 12-kertaiseksi. Koska kokonaismäärä on 12 ja suolahappoa on yksi osa, sekoita suolahappo ja vesi suhteessa 1:11.
※ Huomio: Kun laimennat, älä koskaan lisää vettä happoon tai emäkseen! Liukenemisreaktio voi synnyttää lämpöä, jolloin vesi voi roiskua vaarallisesti. Muista aina lisätä happo tai emäs veteen.
【Suolahapon tapauksessa】
・ Vahvan suolahapon pitoisuus on 12 mol/L. Joten, jotta saat 1 mol/L pitoisuuden, sinun on laimennettava se 12-kertaiseksi. Koska kokonaismäärä on 12 ja suolahappoa on yksi osa, sekoita suolahappo ja vesi suhteessa 1:11.
(Esimerkki) Lisää 10 ml suolahappoa 110 ml:aan vettä.
※ Huomio: Kun laimennat, älä koskaan lisää vettä happoon tai emäkseen! Liukenemisreaktio voi synnyttää lämpöä, jolloin vesi voi roiskua vaarallisesti. Muista aina lisätä happo tai emäs veteen.
【Ammoniakin tapauksessa】
・ Vahvan ammoniakin pitoisuus on 14 mol/L. Joten, jotta saat 1 mol/L ammoniakkiliuoksen, sekoita vahva ammoniakki ja vesi suhteessa 1:13.
※ Jos liuenneena aineena on neste, molaarisuus auttaa tavoitteen mukaisten pitoisuuksien saamisessa. Jos liuenneena aineena on kiinteä aine, molekyylimassa auttaa.Lähde: http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
Natriumhydroksidin laimentaminen
Natriumhydroksidiliuoksen pitoisuustaulukko
【Natriumhydroksidin tapauksessa】
・ Yksi mooli natriumhydroksidia on 40 g. Siksi, kun 40 g natriumhydroksidia liuotetaan litraan vettä, pitoisuus on 1 mol/L.
Kun valmistat 100 ml 1 mol/L (4 %) natriumhydroksidiliuosta, liuota 4 g natriumhydroksidia 100 ml:aan vettä.
※ Natriumhydroksidin liukeneminen veteen on lämpöä vapauttava reaktio. Siksi on helpompi liuottaa se pieneen määrään vettä, odottaa veden lämpenemistä ja lisätä sitten loppu vesi.Lähde: http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
◆ Kun valmistat suuria määriä liuosta (yli 500 ml):
Mittaa tislattu vesi valmistettavaan määrään sopivalla mittalasilla (esim. 500 ml tai 1000 ml). Kaada puolet vedestä suureen A-dekanteriin ja jätä loput mittalasiin.
Käytä vaakaa mittaamaan natriumhydroksidi toiseen, B-dekanteriin. Lisää se välittömästi A-dekanterin tislattuun veteen ja sekoita hyvin. Lisää sitten mittalasiin jäänyt tislattu vesi B-dekanteriin pohjalle jääneen natriumhydroksidin liuottamiseksi ja kaada liuos A-dekanteriin.
Säilytä tarvittaessa reagenssipullossa ja kiinnitä etiketti, jossa on kemikaalin nimi, pitoisuus, valmistuspäivä ja tekijä.
◆ Kun valmistat pieniä määriä liuosta (alle 500 ml):
Mittaa tislattu vesi valmistettavaan määrään sopivalla mittalasilla (esim. 100 ml tai 200 ml).
Käytä vaakaa mittaamaan natriumhydroksidi dekanteriin. Lisää välittömästi tislattu vesi ja sekoita hyvin.
Säilytä tarvittaessa reagenssipullossa ja kiinnitä etiketti, jossa on kemikaalin nimi, pitoisuus, valmistuspäivä ja tekijä.
Kuparikloridin pitoisuuden säätäminen elektrolyysissä
Kuparikloridin elektrolyysiliuosta varten käytimme 13 g kuparikloridia, johon lisättiin tislattua vettä, jotta kokonaispaino oli 300 g. Pitoisuus oli noin 3 %. Vaikka liuos on heikko, se riittää kokeiluun. Lisätietoa löydät täältä:
Danielin pariston pitoisuuden säätäminen
#Sinkkisulfaatti-liuos 5 %: 9,8 g sinkkisulfaattia ja 100 g vettä. #Kuparisulfaatti-liuos n. 17 %: 35,7 g kuparisulfaattia ja 100 g vettä.
Tarkemmat tiedot löydät täältä:
Muita hyödyllisiä lähteitä
* Happamuuden ja emäksisyyden testaus: Tässä kokeessa riittää, että lakmuspaperin väri muuttuu. Yleensä pitoisuus 0,3–1 mol/L on riittävä. 0,3 mol/L:n liuokseen suhde on vahva suolahappo:vesi = 1:39. * Metallien reaktio vetyyn: Tässä kokeessa tarvitaan korkeampaa pitoisuutta. Laimenna n. 3 mol/L:n pitoisuuteen. Vahva suolahappo:vesi = 1:3.
Lähde: https://www.ice.or.jp/nc/?action=common_download_main&upload_id=1169
◆ Lopuksi
“Onkohan tämä liian vahvaa?” “Pitäisikö minun laimentaa enemmän?” Nämä epäilyt häviävät, kun tiedät, mitä teet. Oikeanlainen laimentaminen lisää turvallisuutta laboratoriossa ja auttaa opettamaan oppilaille vastuullista tiedettä. Ole varovainen kemikaaleja käsitellessäsi ja välitä samalla eteenpäin tieteen iloa ja kiehtovuutta!
Yhteystiedot
Tutustu tieteen ihmeisiin hauskasti ja helposti! Täältä löydät vinkkejä ja niksejä hauskoihin kotikokeisiin.
・Lisätietoja minusta, Ken Kuwakosta, löydät täältä
・Jos haluat tilata palveluitani (kirjoittaminen, luennot, tiedekerhot, TV-konsultointi, esiintymiset), ota yhteyttä täällä
・Artikkelipäivitykset julkaistaan X:ssä!
![]() Kagaku no Neta Channel (Tieteen juttuja -kanava) jakaa kokeiluvideoita!
Kagaku no Neta Channel (Tieteen juttuja -kanava) jakaa kokeiluvideoita!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[商品価格に関しまましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しまましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)

