¡Aparecen como joyas! Descubre el secreto de la temperatura a través de la recristalización del nitrato de potasio y la sal.
Soy Ken Kuwako, Entrenador de Ciencias. ¡Cada día es un experimento!
¿Alguna vez te has fijado en los cristales en tu vida diaria? En realidad, están mucho más cerca de lo que piensas. Por ejemplo, la escarcha que se forma en las ventanas en invierno, los copos de nieve, e incluso el azúcar y la sal de tu mesa son pequeños cristales. Pero, ¿cuántas veces te has detenido a pensar cómo se forman exactamente? 🤔
El experimento que presentamos hoy, la “Recristalización”, se aborda en el área de Química de primer año de secundaria y es una actividad emocionante que te permite crear con tus propias manos cristales que rara vez notamos a nuestro alrededor. Aprenderemos cómo obtener cristales, en particular, utilizando nitrato de potasio y cloruro de sodio (sal común). A través de este experimento, podrás comprender mejor las propiedades de las sustancias al sentir el efecto de la solubilidad y la temperatura. ¡Veamos el método paso a paso!
Procedimiento del Experimento
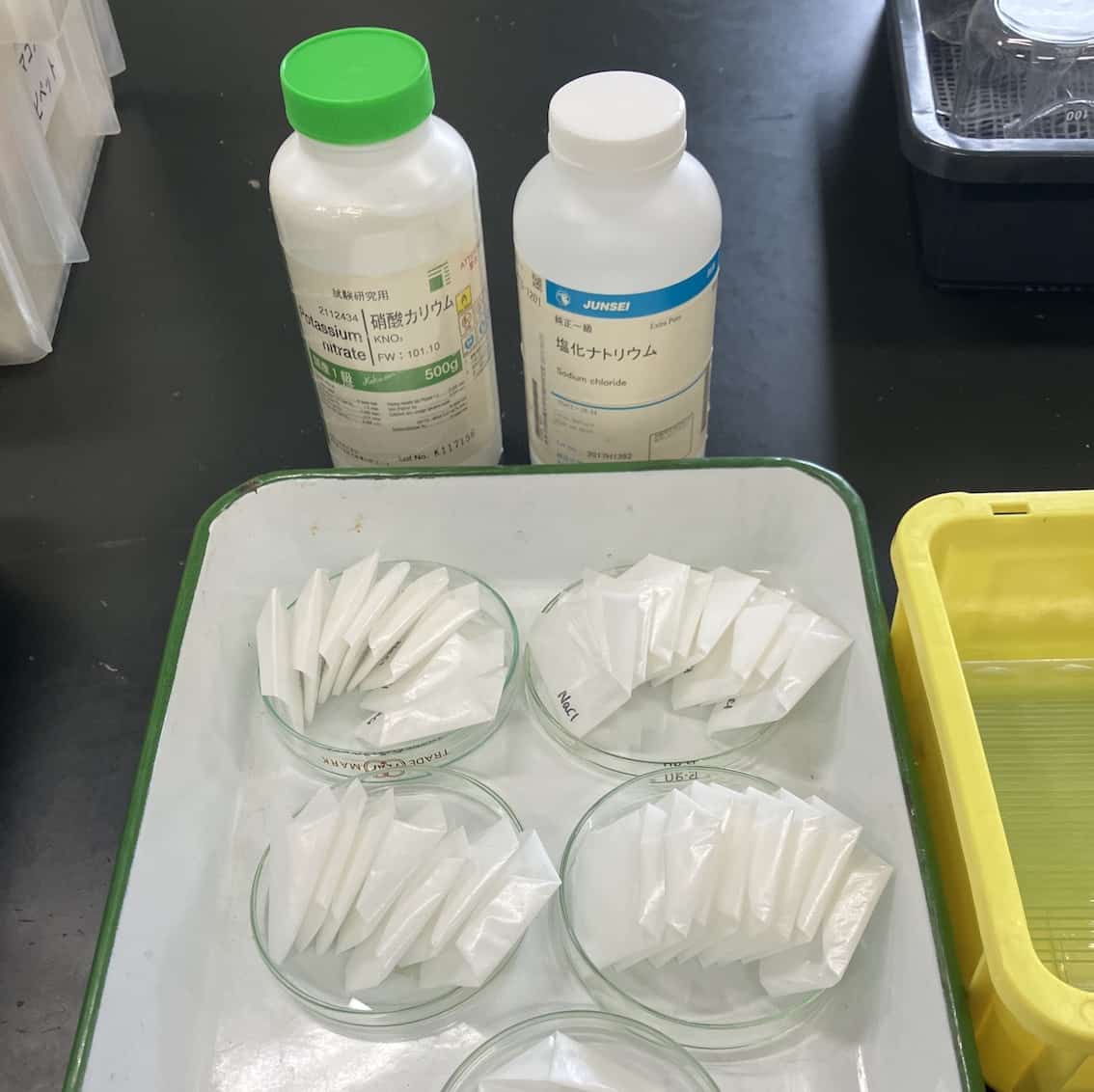
⓪ Preparación Previa
Colocamos 3 g de sal común (etiqueta roja) y 3 g de nitrato de potasio (etiqueta azul) en un papel de pesaje y los guardamos en sendos tubos de ensayo. Pesar previamente la sal común y el nitrato de potasio en el papel de pesaje nos ayuda a ahorrar tiempo. Le pedí a mi asistente de laboratorio que lo hiciera por adelantado. Le tomó alrededor de 30 minutos.
① Disolver en el Tubo de Ensayo
Añadimos 5 mL de agua a cada tubo de ensayo con los 3 g de cada sustancia. Luego, los sumergimos en un vaso de precipitados con agua caliente y los agitamos suavemente para mezclar bien (indiqué que el nitrato de potasio fuera en el tubo con etiqueta azul y el cloruro de sodio en el de etiqueta roja). Hay estudiantes que tienen dificultad para medir los 5 mL con la pipeta. Es necesario dar instrucciones previas sobre cómo sostener y usar la pipeta correctamente.



El nitrato de potasio se disuelve por completo.
Hubo grupos de estudiantes menos rápidos a quienes el agua se les enfrió y no lograron disolver todo por completo. Les añadimos más agua caliente, pero hay que tener cuidado ya que este experimento utiliza los 50 minutos de clase completos. Si después de un tiempo no se ha disuelto todo, transferimos el sobrenadante (la parte disuelta) a otro tubo de ensayo (etiquetado en verde) en una cantidad de aproximadamente 2 mL.
② Enfriar la Solución y Observar
Una vez que el tubo azul (nitrato de potasio) se haya disuelto por completo, o incluso si queda algo sin disolver en el tubo rojo (cloruro de sodio), colocamos ambos tubos de ensayo dentro de un vaso de precipitados con agua fría para enfriarlos. Y entonces… ¡la sustancia disuelta (el soluto) en el nitrato de potasio comenzará a aparecer como cristales! Una vez que aparezcan los cristales, colocamos el tubo en la rejilla de soporte y observamos el fenómeno. Podrás ver hermosos cristales con forma de aguja.


Aspecto de los cristales de nitrato de potasio

El cloruro de sodio no precipita.
③ Filtrar y Observar con Microscopio, etc.

Filtramos la solución de nitrato de potasio a través de un papel de filtro para separar el sólido. Aunque podríamos observarlos de inmediato, queremos ver también los cristales de sal común, así que dividimos la solución en dos partes: una la dejamos evaporar por secado natural y la otra la calentamos hasta la ebullición para evaporar el agua rápidamente. Primero, veamos el método de evaporación por ebullición.
Este es el método de evaporación hirviendo el agua.

Hay que tener cuidado al calentar, ya que la sal puede salpicar. ¡Asegúrense de usar gafas de seguridad! Al final, el resultado es este.

Recogemos las muestras con una espátula y las observamos con una lupa o un microscopio. Al mirar la sal común al microscopio, apenas se ven cristales formados.

Observación al microscopio
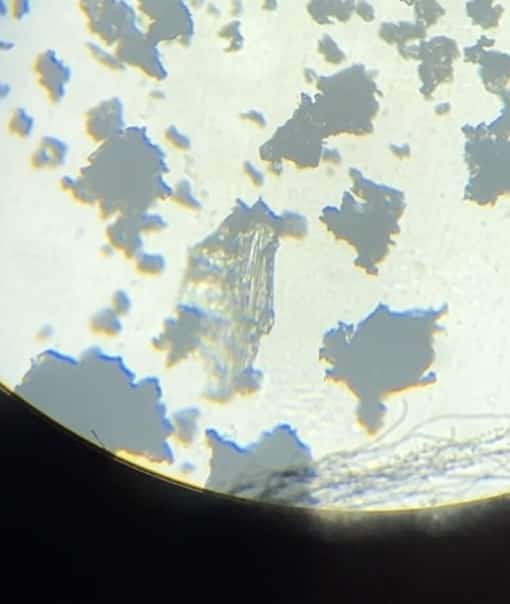
También retiramos los cristales de nitrato de potasio del papel de filtro con una espátula para observarlos al microscopio. Incluso a simple vista, se puede apreciar la increíble delicadeza de los cristales. ¡Son sencillamente hermosos! Se pueden ver los cristales en forma de aguja.

Ampliación:
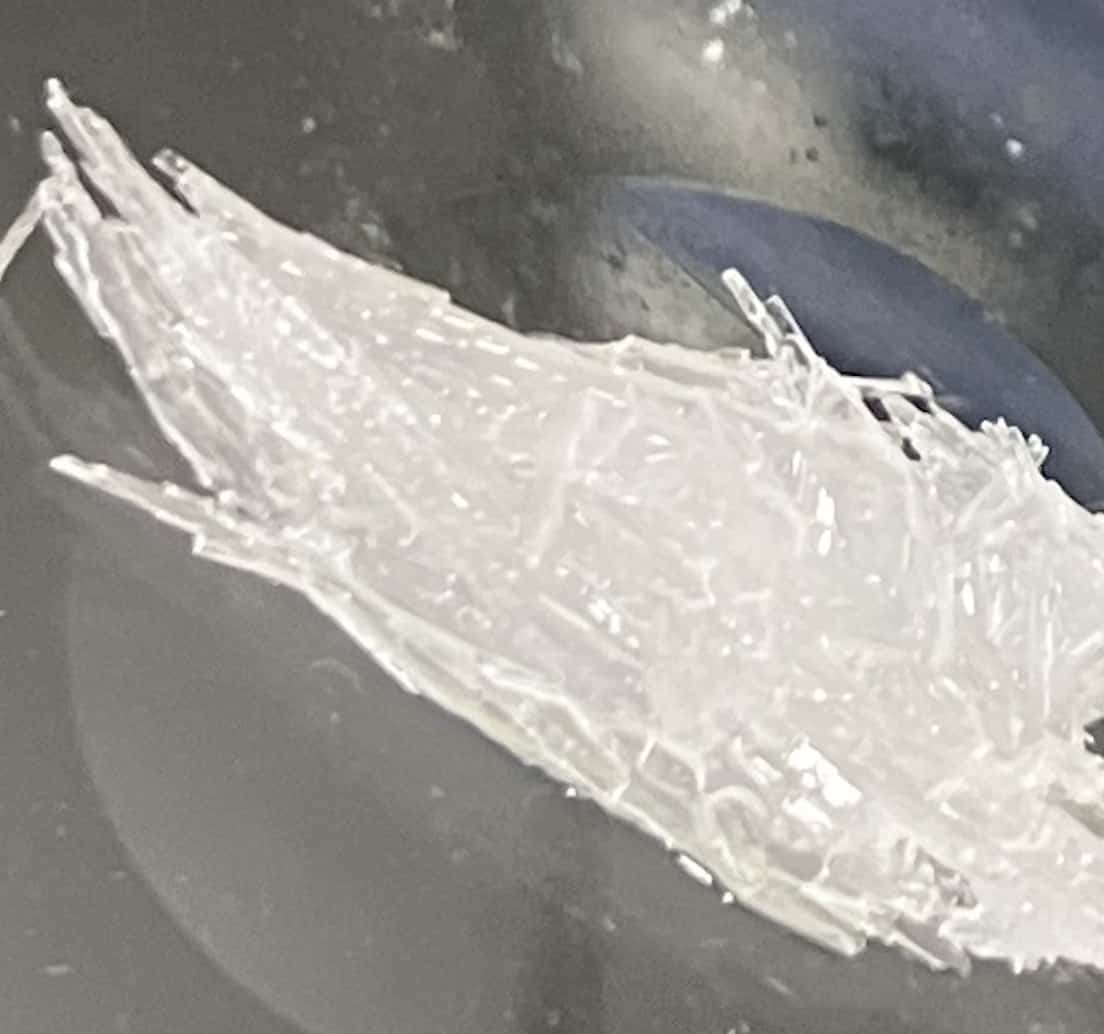
Observación al microscopio sobre un portaobjetos (nitrato de potasio)
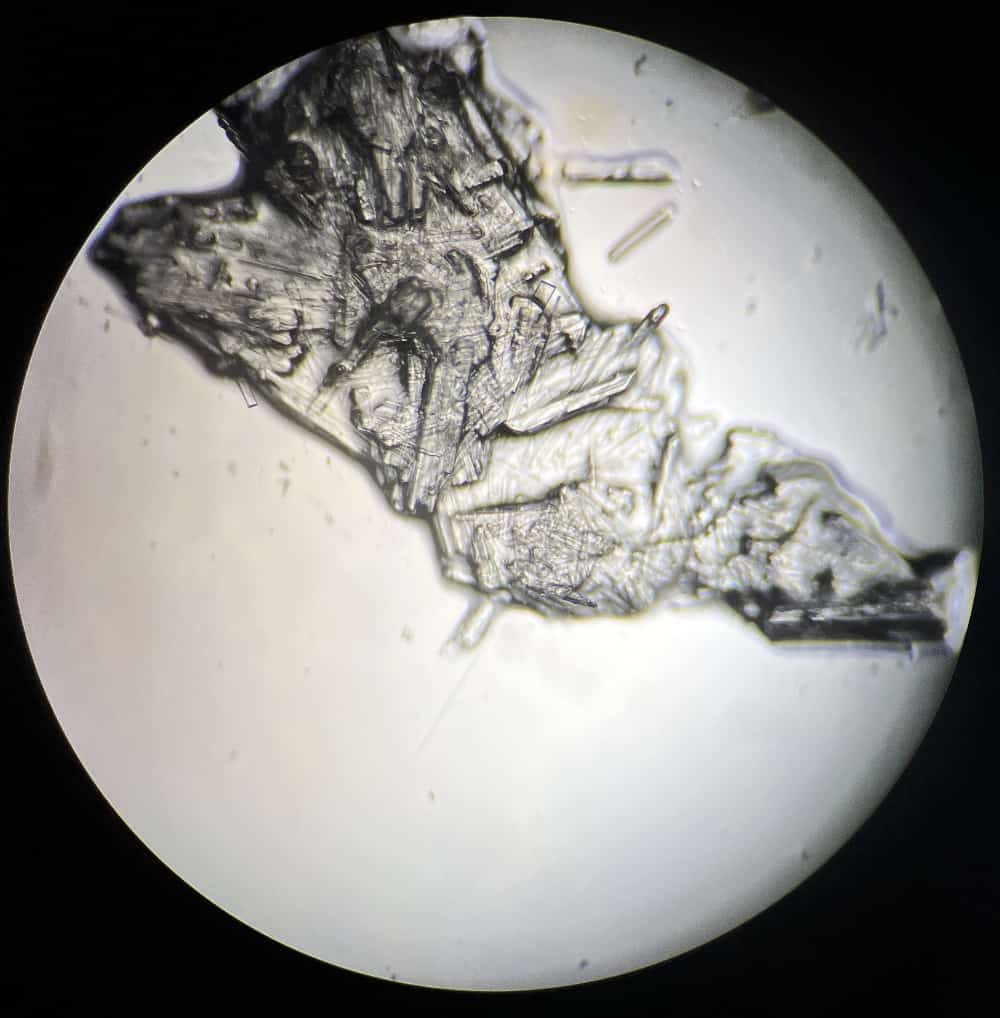
Así se ven. En cuanto a la parte de secado natural, la recogimos y la dejamos caer sobre portaobjetos.

Observaremos esto en la próxima sesión.
④ Observación Posterior de los Cristales de Cloruro de Sodio
Observen con atención la forma y el patrón de los cristales. Tras la observación, no duden en hacer un boceto para registrar su hermosa apariencia. Cristales de cloruro de sodio (se aprecia una estructura similar a un cuadrado).

La estructura cuadrada se puede observar incluso a simple vista. También la observamos al microscopio.

Al ampliar…


De manera similar, el nitrato de potasio que se secó al aire libre. Aquí está:


El experimento de la recristalización es una experiencia muy emocionante que permite presenciar el momento en que un soluto invisible reaparece como un sólido. Al crear cristales con sus propias manos, los estudiantes pueden sentir la maravilla de la ciencia de cerca. Si desean hacer crecer cristales más grandes, ¡sería interesante desafiarlos a probar el método para cultivar y aumentar el tamaño de los cristales como un paso siguiente!
Aquí hay unos cristales hechos por estudiantes del club de ciencias de mi escuela anterior.

También se recomienda ver los cristales de cloruro de amonio. Pueden verlos aquí:
Contacto y Solicitudes
¡Acerca más la maravilla y la diversión de la ciencia! Aquí hemos reunido experimentos científicos divertidos para hacer en casa y sus consejos de forma fácil de entender. ¡No dudes en buscar más!
・Para saber más sobre el operador, Ken Kuwako, haz clic aquí
・Para solicitudes de servicios (escritura, conferencias, clases de experimentos, supervisión/apariciones en TV, etc.), haz clic aquí
・Las actualizaciones de los artículos se publican en X! Síguenos para estar al tanto de las últimas novedades
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



