¡Química con un “Pop!” Desvelando el Secreto del Hidrógeno
Soy Ken Kuwako, tu entrenador de ciencia. ¡Cada día es un experimento!
¿Alguna vez has oído hablar de una sustancia mágica: un “gas limpio que, al quemarse, se convierte en agua”? Pues bien, ese gas es el hidrógeno. ¡En esta ocasión, vamos a ponernos manos a la obra con un emocionante experimento de química para generar este “combustible del futuro” usando materiales que tienes al alcance!
¡A generar hidrógeno!
Hoy, el desafío es producir hidrógeno utilizando zinc y ácido clorhídrico. En una sesión anterior, hicimos un experimento para generar oxígeno, así que ¡será fascinante comparar las diferencias en sus propiedades!
¡Empecemos por la preparación!
Para generar nuestro gas de hidrógeno, utilizaremos los siguientes materiales y equipos:
Materiales
• 1g de zinc (en forma de flor o gránulos pequeños) • 7mL de ácido clorhídrico al 10%

Equipamiento
• 2 tubos de ensayo • Fósforos • Una astilla encendida (apagada, pero aún caliente) • Un trapo húmedo (¡nuestra medida de seguridad de emergencia!)
Procedimiento para recolectar el hidrógeno
① ¡A producir hidrógeno!

Ponemos el ácido clorhídrico diluido en el tubo de ensayo y añadimos el zinc en forma de flor. ¡Observa cómo burbujas diminutas y enérgicas empiezan a efervescer! Este gas es la estrella de hoy: el hidrógeno. Esta reacción se representa en el mundo de la química de la siguiente manera:
Zn (亜鉛) + 2HCl (塩酸) ⟶ ZnCl₂ (塩化亜鉛) + H₂ (水素)
Al disolverse el zinc en el ácido clorhídrico, se transforma en una sustancia llamada cloruro de zinc, y al mismo tiempo, se libera el hidrógeno.
El hidrógeno generado se recolecta en otro tubo de ensayo mediante un método llamado desplazamiento de agua. Si las burbujas salen lentamente (por ejemplo, en invierno), calentar ligeramente el tubo con agua tibia puede activar la reacción.

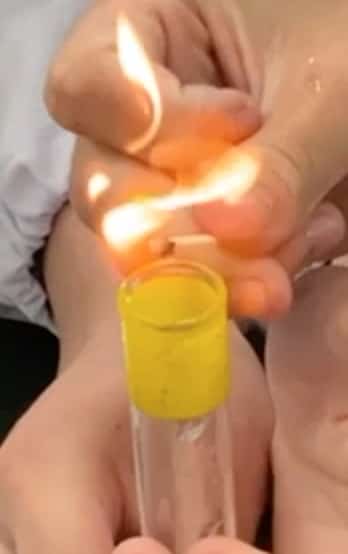
② ¡Acerquemos una llama!
Ahora, acerquemos un fósforo encendido al tubo con el hidrógeno que hemos recolectado. (¡Ojo! Utiliza el segundo tubo de ensayo, ya que el primero podría contener aire mezclado). ¡Aquí va un acertijo! ¿Qué crees que sucederá cuando acerquemos la llama?
La respuesta es… ¡Se quemará con un pequeño sonido de explosión: un “¡Pop!”!
Esto es la prueba de que el hidrógeno ha reaccionado violentamente (combustión) con el oxígeno del aire, transformándose en agua (H₂O). El sonido es una “mini-explosión” que ocurre porque la energía de la reacción hace que el aire circundante se expanda instantáneamente. De hecho, si lo pruebas, verás que el sonido puede variar a un “¡Shubot!” o un “¡Hyun!” dependiendo de las condiciones, ¡lo cual es un descubrimiento interesante!
③ ¡Un experimento extra!
Si logras recolectar un tubo más de hidrógeno, añade un poco de agua de cal (solución de hidróxido de calcio) al tubo y agítalo. En el experimento de oxígeno no hubo cambios con el agua de cal, pero ¿qué pasará ahora? …Lo más probable es que no observes ningún cambio. Sabemos que el agua de cal se enturbia solo en presencia de dióxido de carbono, lo que nos confirma que el hidrógeno y el oxígeno tienen propiedades diferentes.
Profundizando en la ciencia: El misterio del zinc
Usamos “zinc en forma de flor”. La verdad es que la facilidad con la que se genera hidrógeno cambia radicalmente según la forma del zinc. Si es el mismo elemento, ¿por qué ocurre esto?
¡La pista es la “superficie de contacto”!
Imagina, por ejemplo, un terrón de azúcar y azúcar en polvo. ¿Cuál se disolverá más rápido en agua? El azúcar en polvo, ¿verdad? Esto se debe a que el azúcar en polvo tiene un área de contacto (o superficie de contacto) mucho mayor con el agua.
Aplicando el mismo principio, el zinc en forma de flor, con su forma compleja, tiene una superficie de contacto mucho más grande con el ácido clorhídrico que los gránulos de zinc lisos. Esto permite que se produzcan más reacciones, generando hidrógeno vigorosamente. ¡Pensar en estos “porqués” es la esencia de la ciencia! Después del experimento, el zinc pierde su brillo superficial y se vuelve negruzco. Esto sucede porque el zinc se disuelve o se forma otra sustancia en la superficie. Si quisieras reutilizarlo, tendrías que lijar la superficie para que vuelva a brillar.

Izquierda: Antes del experimento. Derecha: Después del experimento.
Resumen
Los estudiantes se acostumbraron rápidamente a manejar los materiales y pudieron completar el experimento con gran destreza en tan solo una hora. ¡Me emociona ver su progreso! Hay muchísimos descubrimientos nuevos cuando observamos los fenómenos cotidianos a través de los ojos de la química. ¡Anímate a buscar tu próximo “por qué”!
Contacto y Solicitudes
¡Acerca la magia y la diversión de la ciencia! En este blog, encontrarás experimentos científicos que puedes hacer en casa y consejos explicados de forma sencilla. ¡No dudes en buscar y explorar!
・El contenido de esta libreta de ideas científicas ya está en formato libro. Para más detalles, haz clic aquí
・Para saber más sobre el administrador, Ken Kuwako, haz clic aquí
・Para cualquier solicitud (escritura, conferencias, talleres de experimentos, supervisión/apariciones en TV, etc.), haz clic aquí
・Las actualizaciones de los artículos se publican en X!
![]() ¡En el Canal de Ideas Científicas publicamos videos de experimentos!
¡En el Canal de Ideas Científicas publicamos videos de experimentos!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



