¿Por qué el agua salada conduce la electricidad y el agua azucarada no? ¡El misterio eléctrico que comienza en tu cocina! (Química)
Soy Ken Kuwako, tu entrenador de ciencia. ¡Cada día es un experimento!
Cuando hablamos en clase de ciencias sobre qué “conduce o no conduce electricidad”, lo primero que se le viene a la mente a muchos estudiantes probablemente sean los metales. Pero lo fascinante de este experimento es que permite a los alumnos comprobar, por sí mismos, que no solo los metales, sino también ciertas sustancias disueltas en agua (soluciones acuosas), ¡pueden conducir la corriente! Hoy vamos a realizar un experimento para verificar si una solución acuosa conduce o no electricidad. Usaremos solo sustancias cotidianas para los estudiantes: sal, azúcar, etanol, etc. Es una actividad que despierta de forma natural la curiosidad y el espíritu investigador, con preguntas como: “¿Eh? ¿El azúcar conduce la electricidad?”. La preparación solo toma unos 40 minutos, y si el equipo está listo de antemano, el experimento puede llevarse a cabo sin problemas durante el tiempo de clase.
Sustancias Utilizadas en el Experimento
Aquí están las soluciones acuosas y sólidos que utilizamos esta vez:
Agua destilada (H₂O)
Agua salada (Solución acuosa de cloruro de sodio, NaCl aq)
Agua azucarada (Solución acuosa de sacarosa, C₁₂H₂₂O₁₁aq)
Ácido clorhídrico (HCl aq)
Etanol (C₂H₆O aq)
Solución de hidróxido de sodio (NaOH aq)
Sal de mesa sólida (NaCl)
Azúcar sólido (Sacarosa, C₁₂H₂₂O₁₁)
Vamos a comprobar cuáles de estas sustancias conducen y cuáles no conducen la corriente eléctrica. ¿Qué resultados obtendremos? Así es como preparamos todo. Dividimos la clase en 8 grupos y separamos las soluciones en dos lotes (1-4 y 5-8), preparando cuatro muestras idénticas de cada una. La idea es poder intercambiarlas rápidamente más tarde.

Soluciones 1 a 4

Soluciones 5 a 8
Las etiquetas las escribimos en cinta de vinilo amarilla con un marcador permanente.


Cubriéndolas con film transparente se pueden conservar por más tiempo.

Nota importante: Las soluciones de agua salada y ácido clorhídrico deben ser reemplazadas después de cada clase, por lo que preparamos 400 mL de cada una. Esto se debe a que se observa un cambio de color.
Cómo se Realizó el Experimento
Los estudiantes utilizaron placas de pocillos (celda de reacción) para dividir cada solución acuosa en porciones. Luego, insertaron electrodos de acero inoxidable, aplicaron un voltaje y verificaron si fluía corriente. El voltaje se ajustó a 5V, y utilizamos un amperímetro analógico, que permite observar incluso los cambios más sutiles. El circuito se configuró de la siguiente manera:


¡No olviden enjuagar los electrodos con agua destilada después de cada experimento! En cuanto a la sal y el azúcar en estado sólido, simplemente se sumergen los electrodos para intentar medir la corriente.
Fenómenos Curiosos Observados con el Ácido Clorhídrico
Veamos los resultados del experimento con el ácido clorhídrico (HCl aq). ¿Qué sucede al introducir HCl en un vaso de precipitados y aplicarle corriente? Observamos que fluyó una corriente considerable de 1.13 A. ¡Es una corriente bastante alta! Además, notamos una gran cantidad de burbujas emergiendo de uno de los electrodos. Estas burbujas son el producto de la electrólisis y es un fenómeno muy interesante de observar. Si los electrodos se dejan en el ácido clorhídrico por mucho tiempo, se genera gas cloro, que se disuelve en el agua, creando ese olor característico a cloro. También pudimos confirmar que se forma agua clorada y la solución cambia de color.


Es fundamental retirar los electrodos después de la observación. En el caso del ácido clorhídrico, se genera cloro, que se disuelve y desprende el olor. También la solución se convierte en agua clorada y cambia de color. En el caso del agua salada, el electrodo de acero inoxidable se disuelve, lo que también provoca un cambio de color en la solución. Aquí se puede ver el cambio en el ácido clorhídrico, que se vuelve amarillo o verdoso:

Antes y después del experimento

¿Qué Pasa con el Agua Salada?
Al hacer pasar corriente por el agua salada (NaCl aq) de manera similar, observamos que el electrodo de acero inoxidable comenzó a disolverse, lo que también provocó que la solución cambiara de color. Otro punto interesante es que, si se mantiene la corriente por mucho tiempo, aparece un precipitado de color naranja en el agua salada.

Antes y después del experimento
Agua salada después de la electrólisis. Se forma un precipitado de color naranja.

Si se deja pasar la corriente por un tiempo prolongado, el color se vuelve muy evidente. A la izquierda, el ácido clorhídrico; a la derecha, el agua salada.

¿Por qué ocurre esto? Para más detalles, consulta este enlace:
La clave está en las siguientes reacciones:
• En el caso del Ácido Clorhídrico: → Se genera cloro en el ánodo, el cual se disuelve en el agua, cambiando el color a amarillo verdoso. Debido al olor a cloro, se recomienda precaución y ventilación. ※Detalles de la reacción aquí
• En el caso del Agua Salada (Solución acuosa de cloruro de sodio): → El electrodo de acero inoxidable reacciona, y a veces se produce un fenómeno en el que el hidróxido de hierro (III) emerge del ánodo, enturbiando la solución con un color marrón o amarillento. En otras palabras, esta es una alteración causada por el material del electrodo, más que una reacción de la propia solución acuosa. ※Explicación detallada aquí o aquí.
Estas son las reacciones que tienen lugar.
¿Qué Soluciones Condujeron la Corriente?
Finalmente, hemos resumido en una tabla cuáles de las soluciones acuosas condujeron electricidad. ¡Aquí están los resultados del experimento!
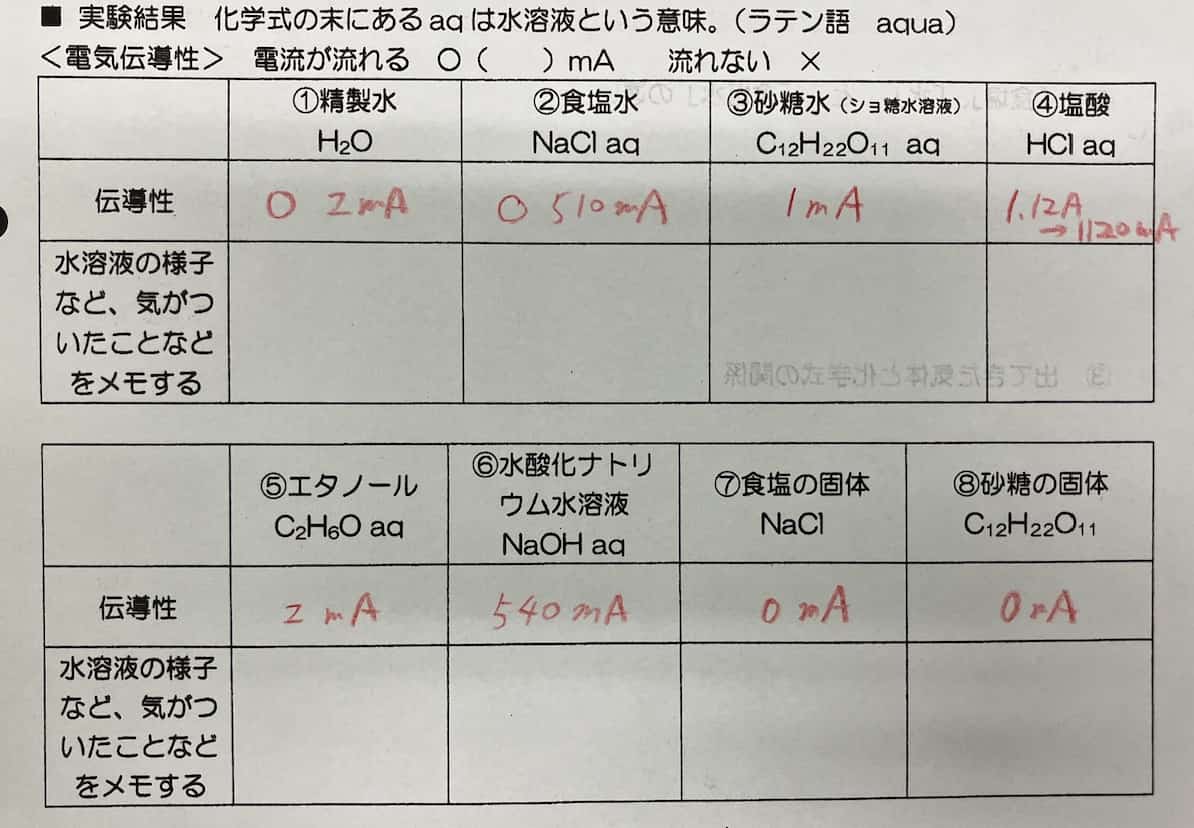
• Agua destilada: Poca conductividad • Agua salada: Conduce • Agua azucarada: Poca conductividad • Ácido clorhídrico: Conduce • Etanol: Poca conductividad • Solución de hidróxido de sodio: Conduce • Sal sólida: No conduce • Azúcar sólido: No conduce
Estos resultados muestran claramente que el agua salada, el ácido clorhídrico y la solución de hidróxido de sodio conducen la corriente. Por el contrario, el agua destilada, el agua azucarada y el etanol tienen poca conductividad, y la sal y el azúcar en estado sólido no conducen en absoluto. A veces, los estudiantes pueden llegar a conclusiones diferentes (que conduce o que no conduce) para una misma sustancia. En estos casos, al ser un problema de cantidad (concentración), puede ser útil compartir los datos de toda la clase para facilitar el análisis. Utilizamos esta hoja de cálculo para ello. Siéntanse libres de copiarla y usarla.
Hoja de cálculo para compartir datos.
Aquí tienen un ejemplo:
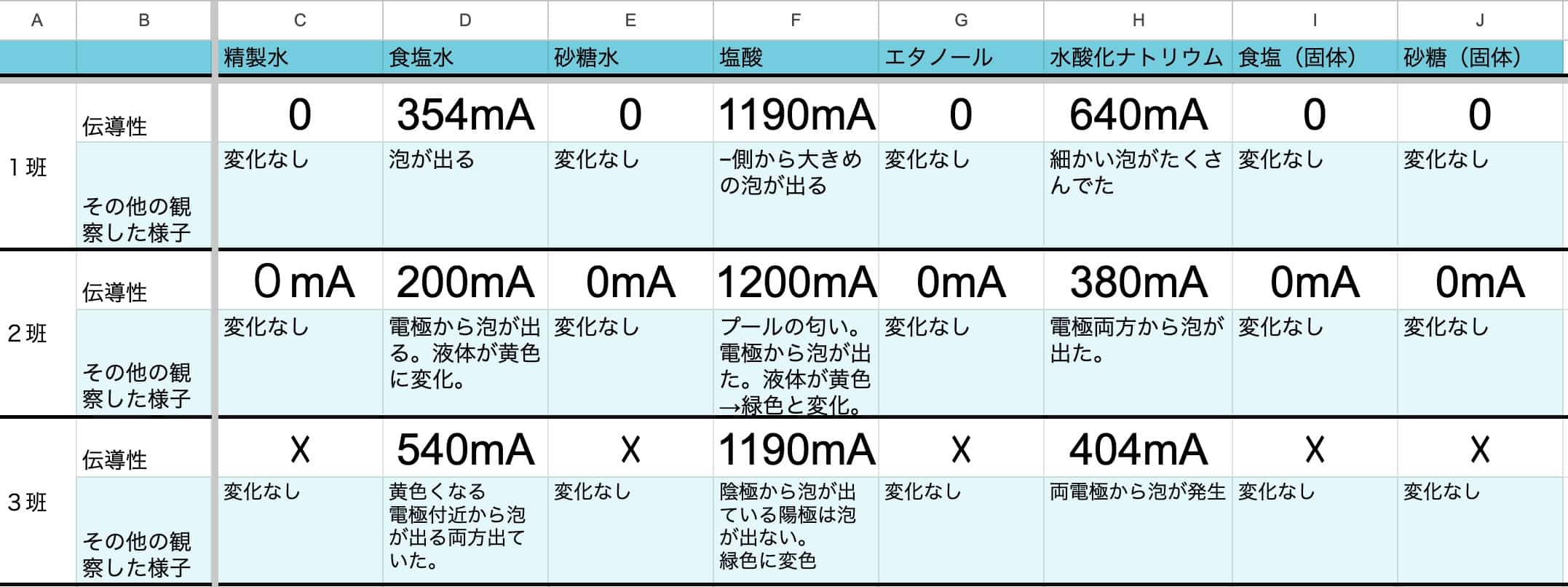
Al resumir los datos en la tabla, queda claro que el agua destilada, el agua azucarada y el etanol tienen poca conductividad, y que la sal y el azúcar sólidos no conducen. En cambio, el agua salada, el ácido clorhídrico y el hidróxido de sodio sí conducen.
Contactos y Solicitudes
¡Acerca la maravilla y la diversión de la ciencia! Aquí hemos recopilado experimentos científicos divertidos que puedes hacer en casa y consejos claros para realizarlos. ¡Anímate a buscar más! ・Acerca del administrador, Ken Kuwako: aquí ・Para solicitudes de servicios (escritura, conferencias, talleres de experimentos, supervisión/apariciones en TV, etc.): aquí ・¡Las actualizaciones de artículos se publican en X!
![]() ¡En el canal de YouTube Kagaku no Neta Channel publicamos videos de experimentos!
¡En el canal de YouTube Kagaku no Neta Channel publicamos videos de experimentos!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



