염산・황산・암모니아・염화구리 희석 방법 (희석의 기본을 마스터하자! ~올바른 약품 사용법과 수업 준비~)
[speech_bubble type=”rtail” subtype=”L1″ icon=”5.png” name=”쿠와코 켄”]사이언스 트레이너 쿠와코 켄입니다. 매일이 실험이죠.

과학실에서 약품을 다룰 때, “안전하게・정확하게・효율적으로” 실험을 하려면 희석의 기본 지식이 필수적입니다. 이번에는 약품을 사용할 때 꼭 알아야 할 희석 방법, 안전 수칙, 그리고 실제 실험에서 필요한 농도 기준을 선생님들을 위해 정리해 봤습니다. 원래 제가 궁금해서 개인적으로 조사하고 정리한 내용이지만, “꼼꼼하게 준비했다”는 사실은 큰 안심이 되죠. 실패 없는 준비가 곧 수업의 질을 좌우합니다. 이 글을 읽으시면 자주 사용하는 약품의 희석법에 대한 고민이 말끔히 해결될 겁니다.
예를 들어 하마지마 서점의 과학 편람 243페이지 등을 보면, 희석 방법에 대한 제조법 등이 한데 모여 있습니다. 수산화나트륨 전기 분해에 사용할 때는 5% 농도로도 충분하고, 염산 전기 분해에 사용할 염산 농도도 5%면 충분하다는 것을 알 수 있습니다. 이 페이지에서는 더 자세하게, 현장의 선생님들을 위해 실제 용액 제조법을 정리했습니다. 실제 질량 퍼센트 농도에서 몰 농도로 변환하는 계산법 등은 다른 글에서 정리했으니, 이쪽을 참고해 주세요.
염산 희석에 대하여
중학교 과학 실험에서 주로 사용하는 염산은 진한 염산을 한 번에 묽혀서 사용하는 것이 좋다고 합니다. 10% 염산을 만들려면 부피비로 진한 염산 1에 물을 3.2 추가하면 됩니다. 예를 들어 500㎤짜리 진한 염산을 모두 10%로 만들려면 1600㎤의 물로 희석하면 되므로, 3리터짜리 폴리에틸렌 용기(amazon)에 묽혀 보관하면 편리합니다.

|
|
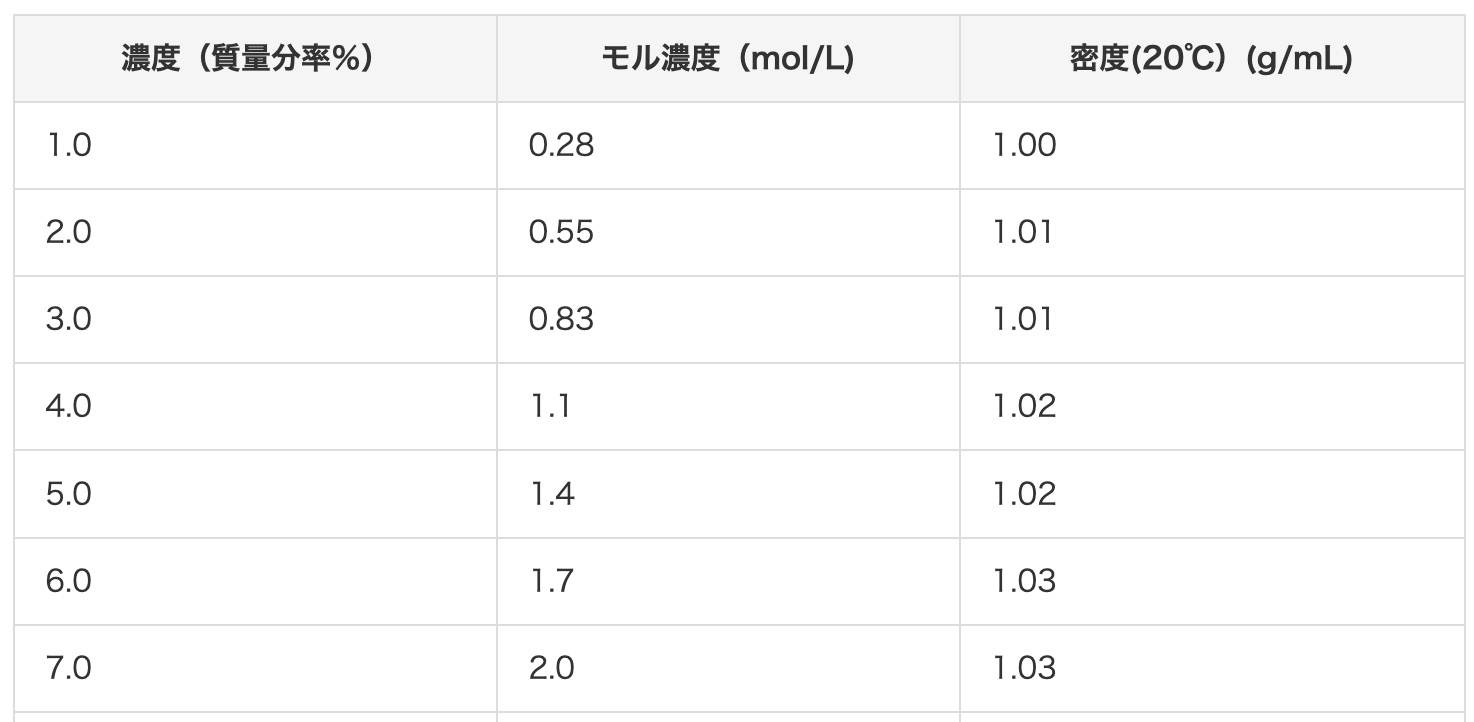
희석 방법에 대해서는 여기를 참고해 주세요.
그래도 걱정되신다면 식으로도 확인해 보죠.
예를 들어, 진한 염산은 12mol/L이고 밀도는 1.18g/mL이므로, 진한 염산 1L(1000mL) 용액의 질량은
1.18×1000=1180g
또한, 용질의 질량은 분자량을 36.5라고 하면
12×36.5=438g
따라서 진한 염산의 질량 % 농도는
438/1180=37.1%
입니다. 이 농도를 물을 더해 10%로 만들려면, 추가할 물의 양을 x[g]라고 할 때,
438/(1180+x)=10/100
x=3200g
이 됩니다. 즉, 염산 1L에 물 3.2L를 더하면 농도가 10%인 염산이 됩니다. 염산이 500mL라면 그 절반인 1.6L가 되겠죠.
주의사항
염산을 희석할 때는 물에 염산을 추가해야 합니다. 산이나 알칼리에 물을 추가하면(×) 용해열로 인해 물이 튀어 위험할 수 있기 때문입니다. 염산이나 황산의 희석 방법 등에 참고가 될 만한 사이트들을 모아 봤습니다. 참고로 진한 염산과 진한 황산의 농도 차이는 용해도 차이 때문이라고 합니다.

농도 9%일 경우, 규정 농도 N은 약 2.6 (2.6mol/L)
농도 4%일 경우, 규정 농도 N은 약 1 (1mol/L)
참고: http://www.keins.city.kawasaki.jp/9/ke9004/benrihp060821/2020.benrichou.ensan.pdf
진한 염산의 농도는 12mol/L이다. 따라서 1mol/L의 농도로 만들려면 12배 희석해야 한다. 총량이 12이고 그 안에 염산이 1인 비율이므로, 염산 1 : 물 11의 비율로 섞는 것이 좋다.
※주의 희석할 때, 산이나 알칼리에 물을 추가하면 용해열로 인해 물이 튀어 위험할 수 있다. 희석할 때는 반드시 물에 산이나 알칼리를 추가하도록 한다.
【염산의 경우】
・ 진한 염산의 농도는 12mol/L이다. 따라서 1mol/L의 농도로 만들려면 12배 희석해야 한다. 총량이 12이고 그 안에 염산이 1인 비율이므로, 염산 1 : 물 11의 비율로 섞는 것이 좋다.
(예) 물 110mL에 염산 10mL를 넣는다.
※주의 희석할 때, 산이나 알칼리에 물을 추가하면 용해열로 인해 물이 튀어 위험할 수 있다. 희석할 때는 반드시 물에 산이나 알칼리를 추가하도록 한다.
【암모니아수의 경우】
・ 진한 암모니아수는 14mol/L이다. 따라서 1mol/L 암모니아수를 만들 때는 진한 암모니아수 1 : 물 13의 비율로 섞는 것이 좋다.
※ 용질이 액체라면 몰 농도를, 고체일 경우 분자량을 알면 원하는 농도의 수용액을 만들 수 있다.참고 http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
수산화나트륨 희석에 대하여
【수산화나트륨의 경우】
・ 수산화나트륨 1몰은 40g이다. 따라서 40g의 수산화나트륨을 물에 녹여 1L로 만들 때가 1mol/L이다.
1mol/L(4%)의 수산화나트륨 수용액 100mL를 만들 때는 4g의 수산화나트륨을 물에 녹여 100mL로 만든다.
※ 수산화나트륨은 물에 녹을 때 발열 반응을 일으킨다. 따라서 소량의 물에 녹여 수온을 높인 다음 나머지를 녹이면 쉽다.참고 http://www.edu.pref.kagoshima.jp/curriculum/rika/shou/syougakkou2/gihouhtm/01page/page03.htm
◆많은 양의 용액(약 500mL 이상)을 만들 경우
1 만들 용량을 측정할 수 있는 메스실린더(예: 500mL를 만들 경우 500mL 또는 1000mL)로 증류수를 재서, 절반은 큰 비커 A에 옮기고 나머지는 메스실린더에 남겨 둡니다.
2 저울을 이용해 다른 비커 B에 수산화나트륨을 재서, 바로 1의 비커 A의 증류수에 넣고 잘 섞습니다. 2의 비커 B 바닥에 남아있는 수산화나트륨은 메스실린더의 증류수를 더해 녹인 후 1의 비커 A로 옮깁니다.
3 필요하다면 시약병에 옮겨 보관합니다. 시약명, 농도, 제조일, 제조자 등을 적은 라벨을 붙이세요.◆소량의 용액(약 500mL 미만)을 만들 경우
1 메스실린더(예: 100mL를 만들 경우 100mL 또는 200mL)로 증류수를 잽니다.
2 저울을 이용해 비커에 수산화나트륨을 재서, 바로 1에서 잰 증류수를 넣고 잘 섞습니다.
3 필요하다면 시약병에 옮겨 보관합니다. 시약명, 농도, 제조일, 제조자 등을 적은 라벨을 붙이세요.
염화구리 전기 분해에 사용할 농도 조절에 대하여
전기 분해에 사용하는 염화구리 용액은 염화구리 13g을 취해 증류수를 넣어 300g의 수용액으로 만들었습니다. 약 3%의 염화구리 수용액입니다. 자세한 내용은 여기를 참고해 주세요. 묽은 용액이지만 실험에는 충분합니다.
다니엘 전지 농도 조절에 대하여
#황산아연 수용액 5% 9.8g에 물 100g #황산구리 수용액 약 17% 35.7g에 물 100g
자세한 내용은 여기에 정리했습니다.
기타 참고할 만한 사이트
* 산성·알칼리성 확인 실험 이 실험은 리트머스 종이의 색이 변하기만 하면 되므로, 보통 약 0.3~1mol/L 정도면 충분합니다. 0.3 mol/L라면, 진한 염산:물=1:39 * 금속을 넣어 수소 발생 실험 금속을 녹이는 실험은 어느 정도 농도가 필요합니다. 약 3 mol/L로 묽히세요. 진한 염산:물=1:3
참고 https://www.ice.or.jp/nc/?action=common_download_main&upload_id=1169
◆마무리하며
“너무 진하게 만들었나…”, “더 묽혀야 했나?”라는 불안감은 사전 지식과 준비만으로 충분히 해소할 수 있습니다. 희석 방법을 제대로 익혀두면 실험 시 안전성도 높아지고, 학생들에게 올바른 과학적 태도를 가르치는 데도 도움이 됩니다. 약품 취급에 충분히 주의하며 과학의 즐거움과 깊이를 함께 느껴보세요!
문의・의뢰에 대하여
과학의 신기함과 재미를 더 가까이에서 느껴보세요! 집에서 할 수 있는 재미있는 과학 실험과 그 팁들을 알기 쉽게 정리했습니다. 이것저것 찾아보세요!
・운영자 쿠와코 켄에 대해서는 여기를 참고하세요
・각종 의뢰(집필, 강연, 실험 교실, TV 자문, 출연 등)는 여기로
・글 업데이트 소식은 X에서 확인하세요!
![]() 과학 이야기 채널에서 실험 영상을 올리고 있습니다!
과학 이야기 채널에서 실험 영상을 올리고 있습니다!

![[상품 가격은 링크가 생성된 시점과 현재 시점에서 정보가 변경될 수 있습니다.] [상품 가격은 링크가 생성된 시점과 현재 시점에서 정보가 변경될 수 있습니다.]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)

