¡El juego de las sillas de los metales! “¡Quiero ser un ion!” Experimento a microescala sobre la reactividad metálica
Soy Ken Kuwako, Entrenador de Ciencias. ¡Cada día es un experimento!
¿Por qué un clavo de hierro se oxida, pero un anillo de oro (gold) brilla eternamente? ¿Cómo es que una simple pila seca genera electricidad con solo combinar metales? El secreto se esconde en el deseo ardiente de los metales por convertirse en iones, es decir, en su “facilidad para ionizarse”.¡Hoy les presento un experimento ecológico que nos permitirá medir la “seriedad” de este deseo invisible en los metales, y que puede realizarse a microescala (súper compacto)! La clave está en usar “poca cantidad de reactivos, una gran visibilidad y seguridad”. Lo mejor es que es fácil de entender para estudiantes de secundaria y requiere muy poca preparación. Tanto a los que aman la química como a los que piensan “quizás se me da un poco mal…” ¡el cambio de colores les fascinará!Puede que el concepto de “el metal se convierte en ion en una solución acuosa” no sea muy intuitivo, pero al ver el cambio dramático de color del metal o cómo el azul de la solución desaparece, ¡podrán decir “ah, claro, es esto”! Además, al usar microplacas o pequeños botes (botellas), reducimos drásticamente los residuos líquidos, minimizando el impacto ambiental del experimento.A continuación, les muestro el proceso completo: desde la preparación y la observación hasta la reflexión sobre el “¿por qué sucede esto?”.
Materiales Necesarios
| Herramienta/Reactivo | Descripción ||—|—|| Planchas de cobre, zinc y magnesio | Nuestros protagonistas: ¡los tres metales “jugadores”! ||
- Solución de sulfato de cobre (3%) | Iones de Cobre (Color Azul)
- Solución de sulfato de zinc (3%) | Iones de Zinc (Incoloro)
- Solución de sulfato de magnesio (3%) | Iones de Magnesio (Incoloro)
| | 💡 Tip (Recomendación): Los “petit bottles” (pequeñas botellas) del fabricante Narika (ver aquí) son excelentes para controlar la cantidad gota a gota, y la experiencia de uso es totalmente diferente a las que se encuentran en tiendas de descuento.
💡 Tip (Recomendación): Los “petit bottles” (pequeñas botellas) del fabricante Narika (ver aquí) son excelentes para controlar la cantidad gota a gota, y la experiencia de uso es totalmente diferente a las que se encuentran en tiendas de descuento.
https://www.rika.com/product/detailed/S75-1140-02
Otros materiales que necesitamos son: una microplaca (para observar la reacción con poca cantidad), pinzas y gafas de seguridad.
Preparación de Reactivos (Cómo hacer soluciones al 3%)
La preparación de los reactivos es la siguiente. Es un poco más técnico, así que es una nota para los profesores.
Cómo hacer la solución de sulfato de cobre (3%): Disolver 4.9 g de sulfato de cobre (II) pentahidratado ($CuSO_4 \cdot 5H_2O$) en 100 g de agua.Cómo hacer la solución de sulfato de zinc (3%): Disolver 5.6 g de sulfato de zinc heptahidratado ($ZnSO_4 \cdot 7H_2O$) en 100 g de agua.Cómo hacer la solución de sulfato de magnesio (3%): Disolver 6.5 g de sulfato de magnesio heptahidratado ($MgSO_4 \cdot 7H_2O$) en 100 g de agua.
Pasos del Experimento
Preparación de las placas de metalLije suavemente cada placa de metal para devolverle su brillo superficial. Esto elimina la capa de óxido (óxido, etc.) y revela la “cara real” del metal, lo que hace que la reacción se produzca mucho más fácilmente.Colocar los metales en la microplacaColoque trozos de los 3 tipos de metal en cada celda (los pequeños pocillos) de la placa. (Usaremos 9 celdas para probar todas las combinaciones: 3 tipos de metal × 3 tipos de solución).Añadir las soluciones gota a gotaUse los “petit bottles” para añadir unas 3 gotas de la solución correspondiente a cada metal.Observar la reacciónPreste atención a tres puntos clave: el cambio de color, la aparición de burbujas y el aspecto de la superficie del metal.
Resultados y Ejemplos de Observación
Aquí tienen los resultados del experimento:https://youtu.be/3Wj6nx0YqKQAsí se ve la placa de celdas. De los 9 patrones, se observaron reacciones claras en algunas celdas (como las tres celdas inferiores izquierdas en la imagen). Los cambios más dramáticos se observaron en los metales sumergidos en la solución azul de sulfato de cobre.
Los cambios más dramáticos se observaron en los metales sumergidos en la solución azul de sulfato de cobre.
【Solución de Sulfato de Cobre × Placa de Magnesio】
 Izquierda: antes de la reacción; Derecha: después de la reacción
Izquierda: antes de la reacción; Derecha: después de la reacción

El trozo de magnesio se ha adelgazado un poco (se ha disuelto).

Derecha: nuevo; Izquierda: después de la reacción. La superficie se ha vuelto negra.
Al añadir el magnesio, la superficie se vuelve rápidamente negruzca, ¡y el color azul de la solución se aclara! La propia placa de magnesio también se ha disuelto un poco (se ha adelgazado).
【Solución de Sulfato de Cobre × Placa de Zinc】
 Izquierda: antes de la reacción; Derecha: después de la reacción
Izquierda: antes de la reacción; Derecha: después de la reacción De manera similar, la placa de zinc adquirió un depósito rojizo en su superficie. Aunque no tan violento como con el magnesio, la reacción es evidente.
De manera similar, la placa de zinc adquirió un depósito rojizo en su superficie. Aunque no tan violento como con el magnesio, la reacción es evidente.
【Solución de Sulfato de Cobre × Placa de Cobre】
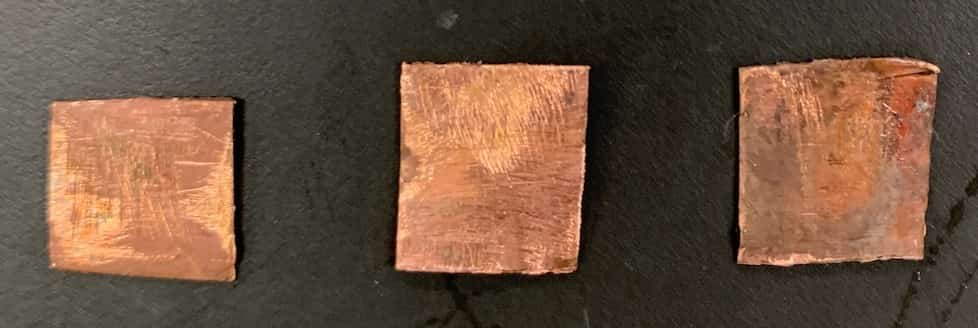 La placa de cobre no mostró ningún cambio al ser sumergida en la solución de sulfato de cobre.En resumen, los cambios observados en las combinaciones fueron:CombinaciónObservaciónSulfato de Cobre × MagnesioSuperficie del metal se vuelve negra, aparece precipitadoSulfato de Cobre × ZincDepósito rojizo en la superficie del metalSulfato de Cobre × CobreSin cambios
La placa de cobre no mostró ningún cambio al ser sumergida en la solución de sulfato de cobre.En resumen, los cambios observados en las combinaciones fueron:CombinaciónObservaciónSulfato de Cobre × MagnesioSuperficie del metal se vuelve negra, aparece precipitadoSulfato de Cobre × ZincDepósito rojizo en la superficie del metalSulfato de Cobre × CobreSin cambios
Reflexión: La Tendencia a la Ionización de los Metales (Serie de Actividad)
A partir de estos resultados de reacción, podemos deducir el orden de los metales según su facilidad para liberar electrones y convertirse en iones (es decir, la Serie de Actividad o Tendencia a la Ionización):
Magnesio > Zinc > Cobre
El magnesio reacciona de forma más enérgica, mientras que el cobre no reacciona en absoluto. Esto demuestra que el magnesio es el que más fácilmente libera electrones y se ioniza.
Conclusión y Consejos para el Aula
El experimento a microescala combina tres ventajas: ocupa poco espacio, es de bajo costo y es seguro. Los cambios de color son espectaculares, como “el azul desaparece” o “aparece un metal rojo”, lo que hace que el cambio químico sea muy fácil de entender. El hilo conductor de la reflexión (el “¿por qué?”) se convierte en una historia que desvela el misterio, ideal para el trabajo en grupo. Además, los residuos líquidos son solo unas gotas por celda de la microplaca, por lo que la limpieza es sencilla y es respetuoso con el medio ambiente.Entender la tendencia a la ionización es una base fundamental que se conecta con la “Pila de Daniel” (un dispositivo que utiliza la diferencia en la tendencia a la ionización entre el zinc y el cobre para generar electricidad) que se estudia en ciencias de secundaria, y también con el “la corrosión metálica (óxido)” de la química de bachillerato.¡Anímense a explorar la diversión de la química con este emocionante experimento!
Experimentos a microescala en Amazon
Contacto y Solicitudes
¡Acerca la maravilla y el interés de la ciencia a tu vida! Aquí encontrarán experimentos científicos caseros divertidos y consejos fáciles de entender. ¡Busquen más artículos!Sobre el administrador y autor, Ken Kuwako: aquíSolicitudes varias (escritura, conferencias, talleres de experimentos, supervisión/aparición en TV, etc.): aquí– Las actualizaciones de artículos se publican en X.
![]() ¡En el canal de Ciencia de Ken transmitimos videos de experimentos!
¡En el canal de Ciencia de Ken transmitimos videos de experimentos!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



