धातुओं की कुर्सी की दौड़! “मुझे आयन बनना है!” माइक्रोस्केल पर सबसे प्रतिक्रियाशील धातु की खोज
मैं हूँ आपका विज्ञान ट्रेनर (Science Trainer), कुवाको केन। हर दिन एक प्रयोग है!
लोहे की कील में जंग क्यों लग जाती है, जबकि सोने (गोल्ड) की अंगूठी हमेशा चमकती रहती है? एक साधारण बैटरी, धातुओं के मिश्रण से बिजली कैसे पैदा करती है? इस सबके पीछे एक राज़ छिपा है— धातुओं की “आयन (Ion) बनने की तीव्र इच्छा” और उनकी यह इच्छा कितनी मज़बूत है, यानी “धातुओं की आयन बनने की प्रवृत्ति (Tendency to form Ions)“।
आज, हम आपको इन अनदेखी धातुओं की “पक्की नीयत” को माइक्रो-स्केल (अति-लघु) पर परखने का एक पर्यावरण-हितैषी (Eco-friendly) प्रयोग दिखाएंगे! मुख्य बातें हैं: “कम मात्रा में रसायन (Reagents), आसानी से अवलोकन, और सुरक्षा“। यह प्रयोग मिडिल स्कूल के छात्रों के लिए समझना आसान है और सबसे अच्छी बात यह है कि इसमें ज़्यादा तैयारी की ज़रूरत नहीं है। चाहे छात्र रसायन विज्ञान (Chemistry) पसंद करते हों या उन्हें यह थोड़ा मुश्किल लगता हो, रंग बदलने के इस रोमांचक खेल को देखकर हर कोई उत्साहित होगा, यह पक्का है!
जब आप सुनते हैं कि “धातुएँ पानी के घोल (Aqueous solution) में आयन बन जाती हैं”, तो शायद आपको बात पूरी तरह से समझ न आए। लेकिन जब आप अपनी आँखों से धातु का रंग बदलते हुए, या घोल के नीले रंग को गायब होते हुए देखते हैं, तो आप तुरंत समझ जाएंगे, “ओह, तो यह माजरा है!”। इसके अलावा, माइक्रो-प्लेट और छोटे बॉटल्स का उपयोग करके, हम प्रयोग से निकलने वाले बेकार घोल (Waste liquid) को बहुत कम कर सकते हैं, जिससे पर्यावरण पर बोझ भी कम होगा।
इस बार, हम आपको तैयारी से लेकर अवलोकन, और फिर “ऐसा क्यों होता है?” की गहराई तक—सब कुछ विस्तार से बताएंगे।
ज़रूरी सामग्री
उपकरण/रसायन | विवरण — | — तांबे की पत्ती (Copper plate), जस्ते की पत्ती (Zinc plate), मैग्नीशियम की पत्ती | इस प्रयोग के मुख्य 3 धात्विक खिलाड़ी
- 3% कॉपर सल्फेट घोल (Copper Sulfate Solution) | कॉपर आयन (नीला रंग)
- 3% जिंक सल्फेट घोल (Zinc Sulfate Solution) | जिंक आयन (रंगहीन)
- 3% मैग्नीशियम सल्फेट घोल (Magnesium Sulfate Solution) | मैग्नीशियम आयन (रंगहीन)
 💡 सिफारिश: Narika की बनी छोटी बॉटल्स (पुटी बॉटल/プチボトル) (यहाँ देखें) से एक-एक बूँद डालना बहुत आसान होता है, इनका इस्तेमाल 100-येन वाले स्टोर की बॉटल्स से बिल्कुल अलग और बेहतर है।
💡 सिफारिश: Narika की बनी छोटी बॉटल्स (पुटी बॉटल/プチボトル) (यहाँ देखें) से एक-एक बूँद डालना बहुत आसान होता है, इनका इस्तेमाल 100-येन वाले स्टोर की बॉटल्स से बिल्कुल अलग और बेहतर है।

https://www.rika.com/product/detailed/S75-1140-02
अन्य ज़रूरी चीज़ें हैं: एक माइक्रो-प्लेट (एक प्लेट जिसमें कम मात्रा में प्रतिक्रिया देखी जा सके), चिमटी (Tweezers), और सुरक्षा चश्मा (Safety Goggles)।
रसायन कैसे तैयार करें (3% घोल बनाने की विधि)
रसायनों को तैयार करने का तरीका नीचे दिया गया है। यह थोड़ा तकनीकी है, लेकिन यह शिक्षकों के लिए एक नोट है।
3% कॉपर सल्फेट घोल बनाने की विधि: कॉपर(II) सल्फेट पेंटाहाइड्रेट (CuSO4・5H20) 4.9g + 100g पानी में घोलें।
3% जिंक सल्फेट घोल बनाने की विधि: जिंक सल्फेट हेप्टाहाइड्रेट (ZnS04・7H20) 5.6g + 100g पानी में घोलें।
3% मैग्नीशियम सल्फेट घोल बनाने की विधि: मैग्नीशियम सल्फेट हेप्टाहाइड्रेट (MgSO4・7H20) 6.5g + 100g पानी में घोलें।
प्रयोग की विधि
धातु की पत्तियों को तैयार करना
प्रत्येक धातु की पत्ती को हल्के से रेगमाल (Sandpaper) से रगड़ें ताकि उसकी सतह पर चमक आ जाए। ऐसा करने से सतह पर जमी ऑक्सीडाइज़्ड परत (जैसे जंग) हट जाएगी और धातु का “असली रूप” बाहर आ जाएगा। इससे रासायनिक प्रतिक्रिया बहुत तेज़ी से होगी।
धातुओं को माइक्रो-प्लेट में रखना
प्लेट के प्रत्येक सेल (छोटे गड्ढे) में तीनों तरह की धातु के टुकड़े रखें। (हम 9 सेल्स का उपयोग करेंगे, जिसमें 3 तरह की धातुएँ × 3 तरह के घोल के सभी पैटर्न शामिल होंगे)
हर घोल की बूँदें डालनाछोटी बॉटल (पुटी बॉटल) का उपयोग करके, प्रत्येक धातु पर लगभग 3-3 बूँदें घोल की डालें।प्रतिक्रिया का अवलोकन करेंतीन चीज़ों पर ध्यान दें: रंग में बदलाव, बुलबुलों का बनना, और धातु की सतह पर क्या हो रहा है।
प्रयोग के परिणाम और अवलोकन के उदाहरण
वास्तव में प्रयोग करने के बाद ये परिणाम सामने आए:
सेल्स का नज़ारा कुछ ऐसा था। कुल 9 पैटर्नों में से, कुछ सेल्स में साफ़-साफ़ प्रतिक्रियाएँ देखी गईं (जैसे कि चित्र में नीचे बाईं ओर के 3 सेल्स)।

सबसे ज़्यादा नाटकीय बदलाव उन धातुओं में देखा गया, जिन्हें नीले रंग के कॉपर सल्फेट घोल में डाला गया था।
【कॉपर सल्फेट घोल × मैग्नीशियम पत्ती】
 बायाँ (Left) प्रतिक्रिया से पहले, दायाँ (Right) प्रतिक्रिया के बाद
बायाँ (Left) प्रतिक्रिया से पहले, दायाँ (Right) प्रतिक्रिया के बाद

मैग्नीशियम का टुकड़ा थोड़ा पतला हो गया है (यानी घुल गया है)।

दायाँ नया टुकड़ा है, बायाँ प्रतिक्रिया के बाद का। सतह काली हो गई है।
जैसे ही मैग्नीशियम डाला गया, इसकी सतह तुरंत काली पड़ने लगी, और नीले घोल का रंग भी हल्का होता गया! मैग्नीशियम की पत्ती खुद भी थोड़ी घुल गई है (पतली हो गई है)।
【कॉपर सल्फेट घोल × जिंक पत्ती】
 बायाँ प्रतिक्रिया से पहले, दायाँ प्रतिक्रिया के बाद
बायाँ प्रतिक्रिया से पहले, दायाँ प्रतिक्रिया के बाद जिंक की पत्ती पर भी इसी तरह, सतह पर लाल-सा जमाव (Deposit) बन गया। मैग्नीशियम जितनी तेज़ प्रतिक्रिया तो नहीं थी, लेकिन प्रतिक्रिया साफ़ तौर पर हुई है।
जिंक की पत्ती पर भी इसी तरह, सतह पर लाल-सा जमाव (Deposit) बन गया। मैग्नीशियम जितनी तेज़ प्रतिक्रिया तो नहीं थी, लेकिन प्रतिक्रिया साफ़ तौर पर हुई है।
【कॉपर सल्फेट घोल × कॉपर पत्ती】
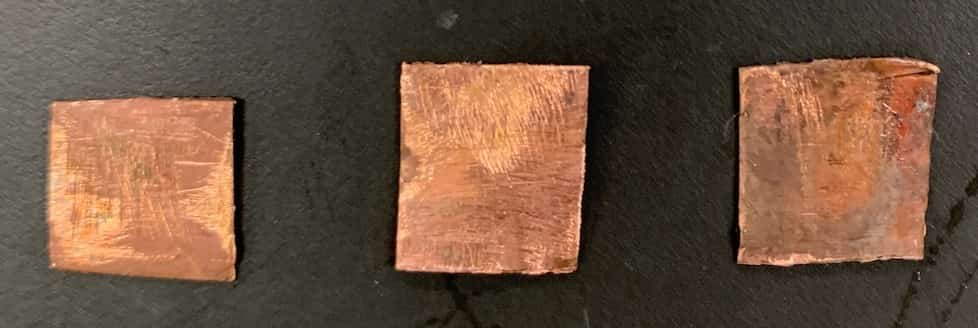 कॉपर की पत्ती को कॉपर सल्फेट घोल में डालने पर कोई बदलाव नहीं हुआ।
कॉपर की पत्ती को कॉपर सल्फेट घोल में डालने पर कोई बदलाव नहीं हुआ।
संक्षेप में, विभिन्न संयोजनों में देखे गए परिवर्तन इस प्रकार हैं:
कॉपर सल्फेट × मैग्नीशियम | धातु की सतह काली हुई, तलछट (Precipitate) दिखाई दिया कॉपर सल्फेट × जिंक | धातु की सतह पर लाल-सा जमाव कॉपर सल्फेट × कॉपर | कोई बदलाव नहीं
यह रहा हमारा अवलोकन।
निष्कर्ष: धातुओं की आयन बनने की प्रवृत्ति (Ionization Tendency/Ionization Series)
इन प्रतिक्रिया परिणामों के आधार पर, हम उन धातुओं का क्रम निकाल सकते हैं जो इलेक्ट्रॉन छोड़कर आयन बनने में सबसे आगे हैं (= आयनीकरण प्रवृत्ति/Ionization Tendency):
मैग्नीशियम > जिंक > कॉपर
मैग्नीशियम ने सबसे तेज़ी से और ज़ोरदार प्रतिक्रिया की, जबकि कॉपर में कोई बदलाव नहीं हुआ। यह दर्शाता है कि मैग्नीशियम आसानी से इलेक्ट्रॉन छोड़कर आयन बन जाता है।
निष्कर्ष और कक्षा में उपयोग के लिए ज़रूरी बातें
कम जगह, कम लागत और सुरक्षा—इन तीन ख़ासियतों से भरपूर है माइक्रो-स्केल प्रयोग। इसमें “नीले रंग का गायब हो जाना” और “लाल धातु का उभरना” जैसे रंगों में नाटकीय बदलाव होते हैं, जिससे रासायनिक परिवर्तन को महसूस करना आसान हो जाता है। निष्कर्ष निकालने का तरीका “ऐसा क्यों होता है?” की कहानी जैसा बन जाता है, जो ग्रुप वर्क के लिए भी एकदम सही है। बेकार घोल (Waste liquid) भी माइक्रो-प्लेट के कुछ बूँदों जितना ही होता है, इसलिए साफ़-सफ़ाई आसान और पर्यावरण के लिए भी यह अच्छा है!
आयनीकरण प्रवृत्ति (Ionization Tendency) को समझना एक बहुत ही ज़रूरी नींव है, जो मिडिल स्कूल विज्ञान में पढ़ाए जाने वाले “डेनियल सेल” (एक उपकरण जो जिंक और कॉपर की आयनीकरण प्रवृत्ति के अंतर का उपयोग करके बिजली पैदा करता है) और हाई स्कूल रसायन विज्ञान में “धातुओं का क्षरण/जंग (Corrosion)” जैसे विषयों से जुड़ा है।
आइए, इस मज़ेदार प्रयोग के साथ मिलकर रसायन विज्ञान के रोमांच को खोजें!
माइक्रो-स्केल प्रयोग amazon
पूछताछ और सहयोग के लिए
विज्ञान के रहस्यों और रोमांच को और नज़दीक लाएँ! हमने घर पर किए जा सकने वाले मज़ेदार विज्ञान प्रयोगों और उनके गुर को आसान भाषा में समझाया है। बेझिझक और भी जानकारी खोजें!・संचालक/लेखक कुवाको केन के बारे में जानने के लिए यहाँ क्लिक करें・विभिन्न सहयोग (लेखन, भाषण, प्रयोग कक्षाएँ, टीवी पर्यवेक्षण, उपस्थिति आदि) के लिए यहाँ क्लिक करें・लेखों के अपडेट X पर उपलब्ध हैं!
![]() विज्ञान के आइडिया का चैनल (Science Idea Channel) पर प्रयोग के वीडियो प्रसारित हो रहे हैं!
विज्ञान के आइडिया का चैनल (Science Idea Channel) पर प्रयोग के वीडियो प्रसारित हो रहे हैं!


