Miksi suolavesi johtaa sähköä, mutta sokerivesi ei? Keittiöstä alkava sähkön salaisuus (kemia)
Tervehdys! Olen tiedekouluttaja Ken Kuwako. Jokainen päivä on kokeilua!
Kun kuulet ”sähköä johtava aine”, mieleesi saattaa nousta kiiltäviä metalleja. Mutta tiesitkö, että voit valmistaa ihmeellisen, sähköä johtavan nesteen ihan vain liuottamalla tavallista, keittiöstä löytyvää ”jauhetta” veteen?
Esittelyssä on nyt tiedekoe, joka on täynnä yllätyksiä ja oivalluksia. Perehdymme yksinkertaiseen mutta syvälliseen arvoitukseen: ”Miksi suolaliuos johtaa sähköä, mutta sokeriliuos ei?” Käytämme aineita, joista olet varmasti kuullut: ruokasuolaa, sokeria ja etanolia. Tämän kokeen avulla selvitämme sähkön salaisuudet, jotka piilevät vedessä. Valmisteluaika on noin 40 minuuttia. Eikö olekin aika avata ovi tieteen maailmaan?
Esittelyssä kokeen ”pelaajat”! Keitä he oikein ovat?
Tässä ovat ne vesiliuokset ja kiinteät aineet, jotka astuvat kokeeseen. Osa läpinäkyvistä nesteistä näyttää aivan samalta, mutta sähkön edessä ne paljastavat täysin erilaiset kasvonsa.
Tislattu vesi (H₂O)
Suolaliuos (NaCl aq)
Sokeriliuos (sakkaroosiliuos C₁₂H₂₂O₁₁ aq)
Suolahappo (HCl aq)
Etanoliliuos (C₂H₆O aq)
Natriumhydroksidiliuos (NaOH aq)
Kiinteä ruokasuola (NaCl)
Kiinteä sokeri (C₁₂H₂₂O₁₁)
Tarkistamme, mitkä näistä ”johtavat sähkövirtaa” ja mitkä ”eivät johda”. Tämän eron takana piilee pienten hiukkasten, nimittäin ionien, olemassaolo. Aineita, jotka veteen liuotessaan hajoavat positiivisesti ja negatiivisesti varautuneisiin ioneihin, kutsutaan elektrolyyteiksi. Nämä ionit toimivat sähkön ”kuriireina”, jotka liikkuvat vapaasti liuoksessa ja saavat virran kulkemaan.
Sen sijaan aineita, jotka eivät liuetessaan hajoa ioneiksi, vaan pysyvät molekyyleinä, kutsutaan ei-elektrolyyteiksi. Näillä ei ole sähkön kuljettajia, joten virta ei kulje. Kumpi siis on elektrolyytti, suola vai sokeri?

Liukot 1–4




※ Huomautus: Suolaliuos ja suolahappo on vaihdettava luokittain kesken kokeen, sillä ne muuttavat väriä reagoidessaan elektrodien kanssa. Itse asiassa tämä värinmuutos on myös todiste mielenkiintoisesta kemiallisesta reaktiosta.
Koekäynti! Etsi sähkön reittiä
Oppilaat jakavat liuokset varovaisesti koekennolevyille kuin oikeat tiedemiehet ja upottavat ruostumattomasta teräksestä valmistetut elektrodit niihin. Jännite asetetaan 5 V:iin, kytkin käännetään päälle… Liikkuuko virtamittarin neula, vai pysyykö se vaiti? Jännitys on käsinkosketeltava.


Jokaisen liuoksen mittaamisen jälkeen on tärkeää pestä elektrodit huolellisesti tislatulla vedellä. Jos liuokset sekoittuvat, oikeaa tulosta ei saada. Vaikka se onkin työlästä, se on ensimmäinen askel kohti tarkkaa dataa.
Mitä ne suolahapossa syntyneet kuplat ovat?
Suolahapolla (HCl aq) tehty koe sisälsi erityisen dramaattisen ilmiön. Heti kun elektrodit upotettiin, virta oli huikeat 1.13 A ja toisesta elektrodista alkoi kuplia kiivaasti!

Nämä kuplat syntyivät ilmiössä, jota kutsutaan elektrolyysiksi – sähkön ”taikatemppu” liuokselle. Suolahapossa olevat ionit muuttivat sähköenergian vaikutuksesta toisiksi aineiksi, eli vetykaasuksi (H₂) ja kloorikaasuksi (Cl₂). Hetken kuluttua huoneilmaan levisi uimahallimainen, tunnusomainen kloorin haju ja liuos muuttui hieman kellertäväksi.

Ennen ja jälkeen kokeen

Mysteeri suolaliuoksessa tapahtuneen värinmuutoksen takana
Myös suolaliuoksessa (NaCl aq) havaittiin mielenkiintoinen muutos. Virran kulkiessa liuos alkoi muuttua vähitellen samean oranssiksi. Mistä tämä johtui?

Ennen ja jälkeen kokeen
Suolaliuos elektrolyysin jälkeen. Muodostuu oranssia sakkaa.

Itse asiassa tämä ei johtunutkaan suolaliuoksen reaktiosta, vaan siitä, että anodin (+-napa) ruostumattomasta teräksestä valmistetusta elektrodista liukeni rautaioneja, jotka muodostivat oranssia sakkana olevaa rauta(III)hydroksidia. On kiehtovaa, kuinka kemiassa itse liuos, mutta myös ”kulissina” toimiva elektrodi osallistuvat reaktioon.
Kun virta annetaan kulkea pidempään, väri erottuu selvästi. Vasemmalla suolahappo, oikealla suolaliuos.

Tarkemman selityksen siitä, miksi näin tapahtuu, voit lukea näistä linkeistä:
Suolahapon tapauksessa → Anodilla syntyy klooria, joka liukenee veteen ja muuttaa liuoksen kellanvihreäksi. Reaktio tarkemmin tästä
Suolaliuoksen tapauksessa → Ruostumaton teräselektrodi reagoi, ja anodista vapautuva rauta(III)hydroksidi samentaa liuoksen rusehtavan tai kellertävän väriseksi. Tarkempi selitys tästä tai tästä.
Lopputulos! Mitkä johtivat sähköä?
Nyt kun kaikki kokeet on tehty, kootaan tulokset yhteen.
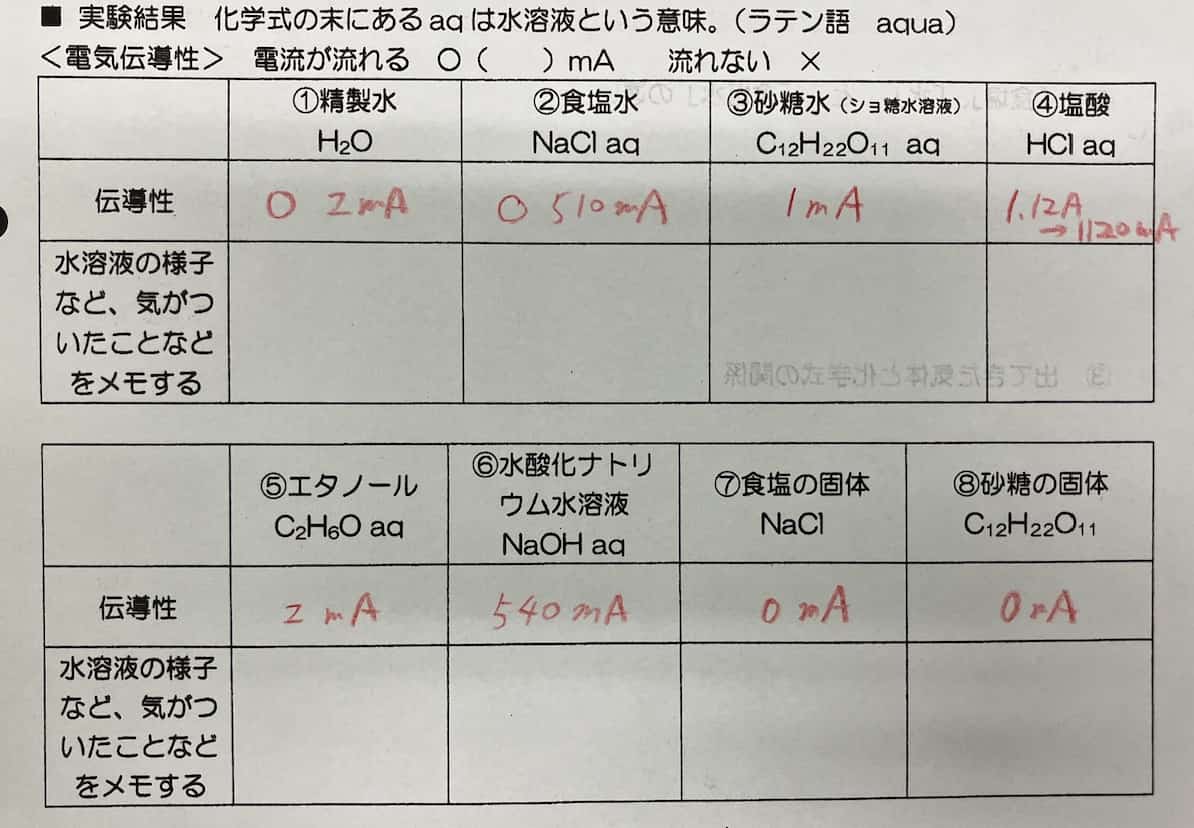
【Johtivat (elektrolyytit)】 Suolaliuos, suolahappo, natriumhydroksidiliuos
【Johtavat heikosti/eivät johda (ei-elektrolyytit)】 Tislattu vesi, sokeriliuos, etanoli
【Eivät johtaneet】 Kiinteä ruokasuola, kiinteä sokeri
Tuloksista näkyy selvästi, että elektrolyytit, kuten suola, vetykloridi ja natriumhydroksidi, johtavat sähköä hyvin veteen liuotettuina.
Erityisen mielenkiintoista on havainto, että kiinteä ruokasuola ei johda sähköä, mutta veteen liuotettuna se alkaa johtaa. Tämä johtuu siitä, että kiinteässä aineessa ionit ovat tiukasti sidottuja kiderakenteeseen eivätkä pääse liikkumaan. Veteen liuetessaan ne vapautuvat ja pääsevät liikkumaan vapaasti. Sähkön kuljettajat, eli ionit, tarvitsevat siis vapaan ”tien (=veden)” voidakseen käyttää voimiaan.
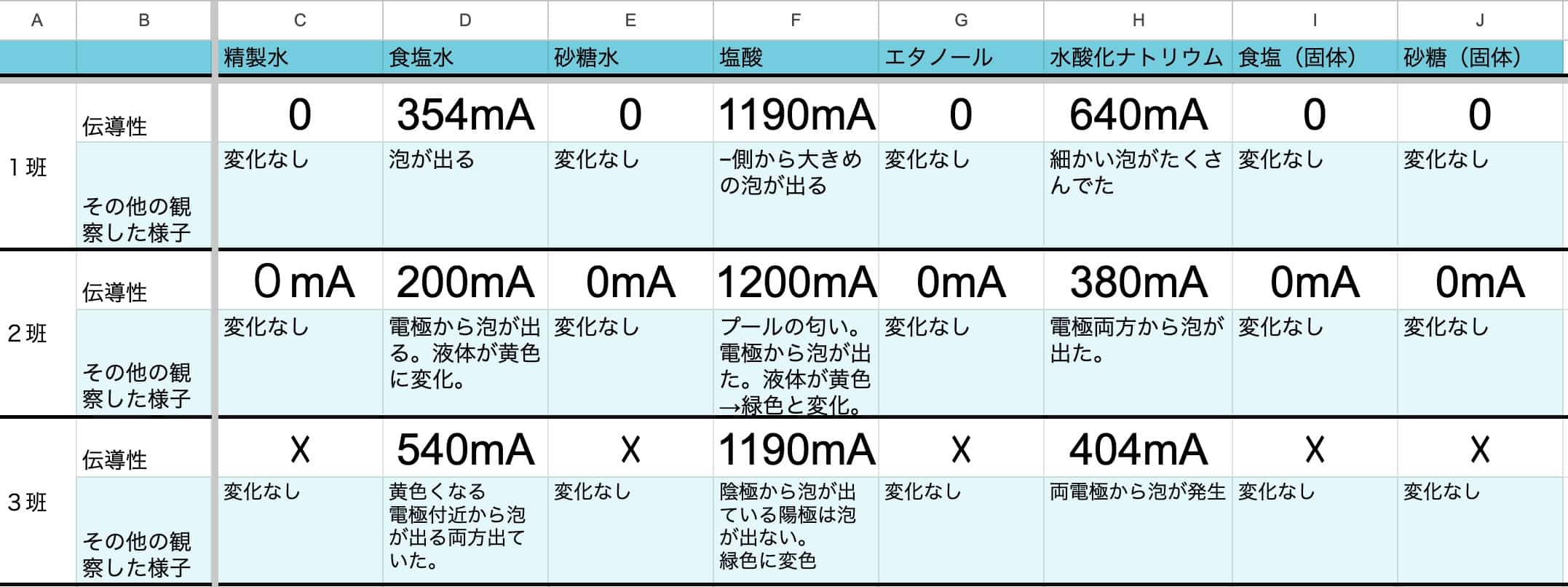
Jos jaat koko luokan tulokset tässä taulukkolaskenta-arkissa, saatat tehdä vielä hauskempia löytöjä. Yksittäisten tulosten vaihteluista huolimatta esiin nousee varma tieteen laki.
Keittiöstäsi löytyvät suola ja sokeri ovat portteja suureen kemian maailmaan. Ehkä sinun ympärilläsi piilee vielä tiedon salaisuuksia, joita et ole huomannut.
Yhteydenotot ja pyynnöt
Tehdään tieteen ihmeistä ja hauskuudesta helpommin lähestyttävää! Olen koonnut ohjeita kotona tehtäviin hauskoihin tiedekokeisiin ja niiden nikseihin selkeästi. Selaa vapaasti! ・Tietoa ylläpitäjä Ken Kuwakosta tästä ・Erilaiset pyynnöt (kirjoitus, luennot, tiedekurssit, TV-konsultointi, esiintymiset jne.) tästä ・Artikkelipäivitykset X:ssä!
![]() Koevideoita Tieteen temput -kanavalla!
Koevideoita Tieteen temput -kanavalla!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



