El Misterio del “Calor Oculto”: ¡El Ácido Palmítico Detiene el Reloj de la Temperatura!
Soy Ken Kuwako, tu entrenador de ciencia. ¡Cada día es un experimento!
Vemos cómo el chocolate se derrite en la palma de nuestra mano o cómo el agua se transforma en un bloque de hielo sólido al meterla en el congelador. A nuestro alrededor, los “cambios de estado” son fenómenos cotidianos, donde la materia cambia de aspecto. Pero, ¿alguna vez te has detenido a observar con detalle qué le ocurre a la “temperatura” de esa sustancia justo en el momento del cambio?
¡Resulta que ahí se esconde un drama científico fascinante! Hoy, vamos a sumergirnos en el misterioso mundo de los cambios de temperatura, usando como protagonista una sustancia muy popular en los laboratorios escolares: el ácido palmítico.
Pero, ¿Quién es el Ácido Palmítico?
Puede que el nombre “ácido palmítico” no te suene de nada. Sin embargo, en realidad es algo muy cercano a nuestra vida diaria.
El ácido palmítico es un tipo de nutriente conocido como “ácido graso” y, como su nombre sugiere, es el componente principal del aceite de palma, que se extrae del árbol del mismo nombre. Se encuentra en multitud de productos que comemos, así como en jabones y cosméticos. A temperatura ambiente, es un sólido blanco parecido a la mantequilla, pero tiene la curiosa propiedad de convertirse en un líquido transparente al calentarse.
En el mundo de la química, tiene esta forma (estructura química). Se caracteriza por su forma alargada, con una hilera de átomos de carbono (C) dispuestos en fila.
¡Manos a la Obra! El Drama Escondido en la Lectura del Termómetro
¡Llegó la hora de la verdad, el momento de experimentar! El objetivo de este experimento es calentar el ácido palmítico y observar con mucha atención cómo cambia la temperatura justo cuando pasa de sólido a líquido. ¡Vamos a replicar con nuestras propias manos esa famosa “gráfica de fusión” que vimos en los libros!
Materiales y Preparación
Si realizaras este experimento en clase, necesitarías:
• Ácido palmítico (una pequeña cantidad es suficiente; es seguro y fácil de manejar).
• Tubo de ensayo (o un vaso de precipitados pequeño).
• Termómetro (digital o analógico).
• Dispositivo de calentamiento (agua caliente, placa calefactora, etc.).
• Cronómetro.
• Hoja de cálculo o papel gráfico (para los alumnos).
Así se montan los materiales:

La temperatura a la que el ácido palmítico se convierte en líquido, conocida como “punto de fusión”, es de 62.9
∘
C. En este umbral, ¡es donde comienza el espectáculo!
Al calentarlo, observa bien…
• Cerca de los 60
∘
C, ¿qué pasa? ¡La temperatura parece subir más lentamente!
• El sólido blanco comienza a transformarse lentamente en un líquido transparente, ¡pero la temperatura casi no varía!
• En el instante en que todo se ha convertido en líquido, ¡la temperatura vuelve a dispararse!
Seguro que ante este cambio tan evidente a la vista, todos gritaréis “¡Vaya!”. Es el momento en que la gráfica del libro de texto cobra vida ante nuestros ojos. En esta ocasión, registraremos los datos en una hoja de cálculo para luego graficarlos. Aquí tienes el archivo para registrar los datos.
La Clave del Éxito: ¡Agua Tibia!
Para capturar este momento tan emocionante, se necesita un pequeño truco. La “forma de calentar” es lo que decide si el experimento sale bien o mal.
Calentar desde agua fría:
Ejemplo)
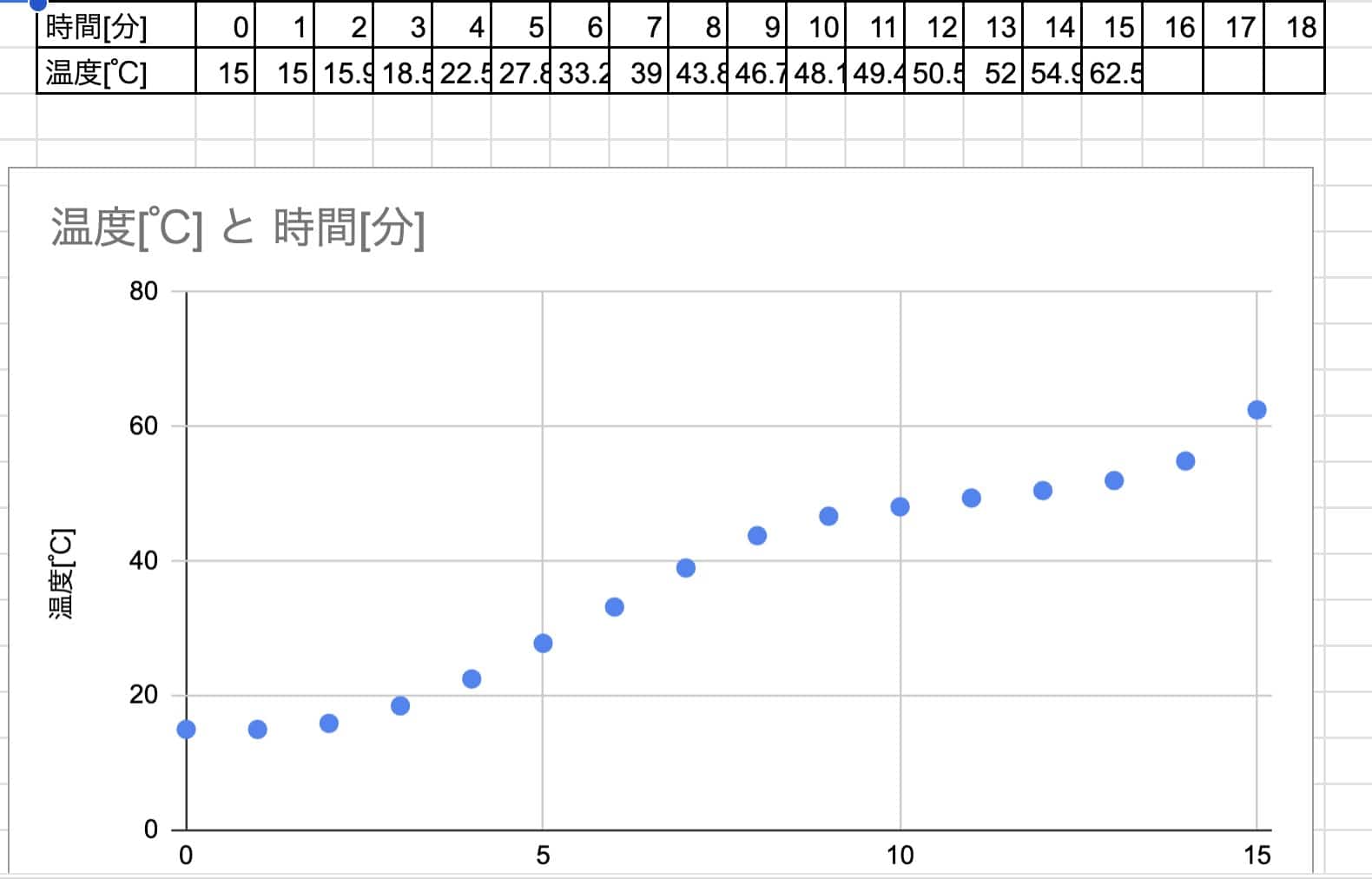
→ ¡Tarda demasiado! No llegamos al punto de fusión dentro del tiempo de la clase…
Calentar desde agua muy caliente:
Ejemplo)
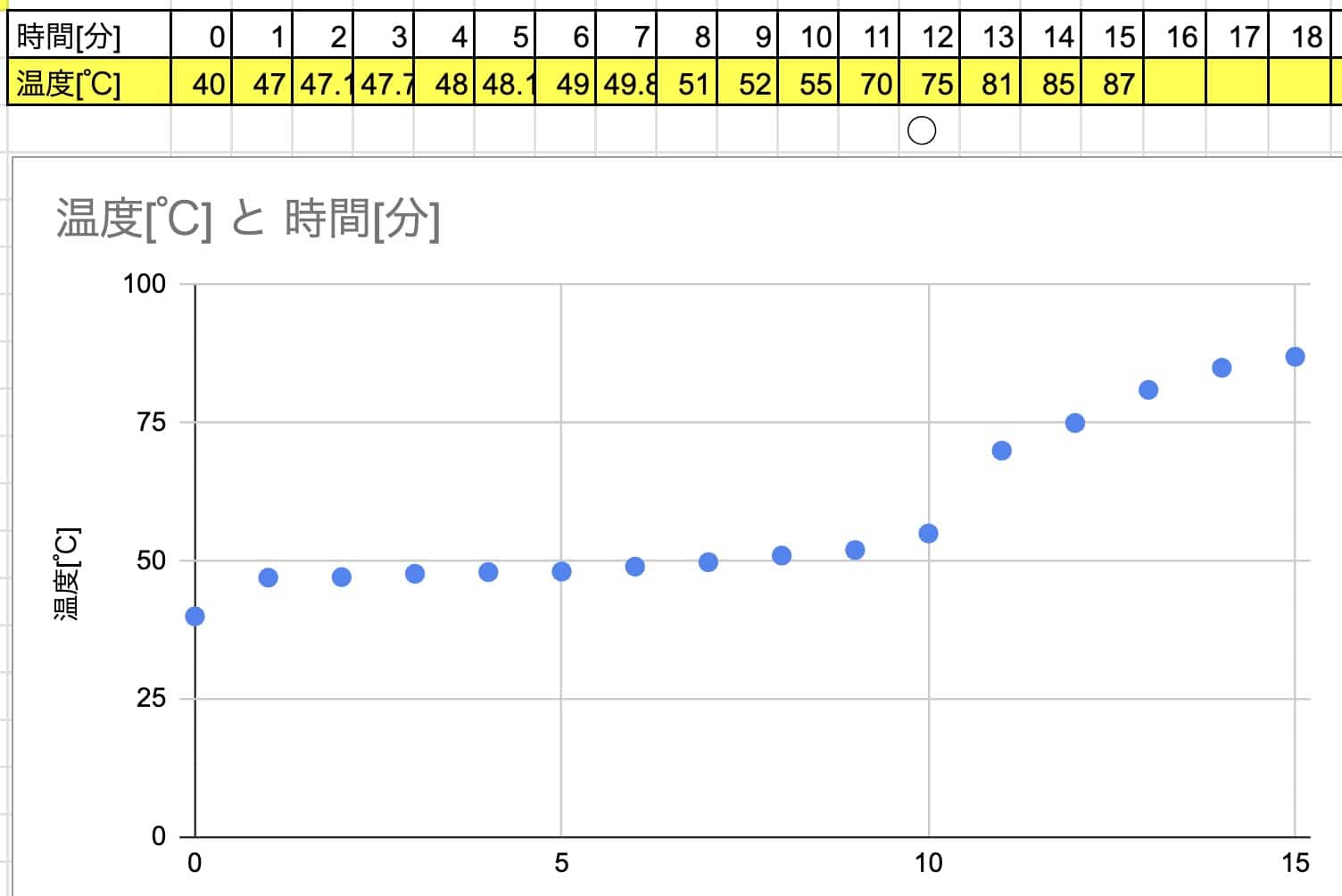
→ ¡Demasiado rápido! El cambio de temperatura es instantáneo y nos perdemos el momento crucial donde la temperatura se detiene…
Calentar desde agua tibia (30
∘
C aproximadamente):
→ ¡Este es el método ideal! Como la temperatura sube lentamente, pudimos observar el drama del cambio de estado con calma y a fondo.



¿Por Qué? El Enigma de la Temperatura que se “Estanca”
Lo más interesante del experimento es ese momento en que, aunque seguimos calentando, la temperatura prácticamente deja de subir, creando un “estancamiento” mientras el sólido se transforma en líquido. ¿A qué se debe esto?
La clave está en el “calor latente”.
El calor latente es, literalmente, el “calor oculto”. En estado sólido, las moléculas están fuertemente unidas en una estructura ordenada. Al añadir energía en forma de calor, las moléculas comienzan a vibrar más intensamente y la temperatura sube.
Sin embargo, al llegar al punto de fusión, la energía térmica que se sigue suministrando ya no se utiliza para aumentar la temperatura, sino para romper los enlaces entre las moléculas y permitirles moverse libremente. Esta es la esencia del “cambio de estado”.
Hasta que todas las moléculas no se liberan y se convierten en un líquido, el calor se dedica por completo a esta “tarea de romper enlaces”. Por eso, la marca del termómetro no sube. Y en el instante en que todas las moléculas están libres y el líquido es completo, la energía térmica vuelve a su tarea de hacer que las moléculas se muevan más rápido, y la temperatura comienza a subir de nuevo.
Esto mismo sucede cuando el hielo se convierte en agua. Si calientas un cubito de hielo recién sacado del congelador, permanece a 0
∘
C hasta que se derrite por completo, ¿verdad? En ese momento, las moléculas de hielo están usando el “calor latente” para transformarse en agua.
Conclusión
Aunque solo calentamos ácido palmítico, este sencillo experimento nos reveló un principio fundamental de la ciencia que se estudia en secundaria: la relación entre el “cambio de estado y el calor latente”.
El instante en que el número del termómetro se ralentiza es la prueba de que, en el mundo invisible de las moléculas, la energía térmica está luchando por cambiar su estado. Este descubrimiento es la mejor experiencia de aprendizaje, donde la teoría y la realidad encajan a la perfección.
Si tienes la oportunidad de hacer algún proyecto de ciencias en casa, recuerda el lema “¡Empieza con agua tibia!” y rastrea el cambio de temperatura de cualquier sustancia que tengas a mano. ¡Seguro que te enamorarás de lo apasionante que es la ciencia!
Contacto y Servicios
¡Acerca la maravilla y la diversión de la ciencia a tu vida! Aquí resumimos experimentos científicos divertidos para hacer en casa y sus trucos, explicados de forma sencilla. ¡Busca otros artículos!
・El contenido de “La Libreta de Ciencia” está ahora en un libro. Más detalles aquí.
・Sobre el administrador, Ken Kuwako, aquí.
・Para solicitudes (redacción, conferencias, talleres de experimentos, supervisión/participación en TV, etc.), aquí.
・Las actualizaciones de los artículos se publican en X.
![]() En el canal de YouTube “Ciencia en un Vistazo” (Kagaku no Netachannel) se publican vídeos de experimentos.
En el canal de YouTube “Ciencia en un Vistazo” (Kagaku no Netachannel) se publican vídeos de experimentos.
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。



