【더 이상 헷갈리지 마세요!】 질량퍼센트 농도와 몰농도를 자유자재로 변환하는 화학 레시피 (규정도 N·ppm)
안녕하세요, 사이언스 트레이너 쿠와코 켄입니다. 매일이 실험이죠.
요리 레시피에 ‘소금 약간’이라고 쓰여 있으면 도대체 얼마나 넣어야 할지 헷갈린 적 없으세요? 사실 화학의 세계에서도 농도를 나타내는 여러 가지 방법이 있어서, 과학자들은 상황에 따라 다르게 사용합니다. 이번에는 과학 실험에서 자주 쓰이는 ‘질량 백분율 농도’와 좀 더 전문적인 ‘몰 농도’라는 두 가지 농도 단위를 자유롭게 넘나드는 방법을 알아볼 거예요. 이 계산법을 알게 되면 화학이 훨씬 더 친근하게 느껴지고, 실험이 더 즐겁고 안전해진답니다!
참고로, 실제 희석 방법은 여기에서 확인해 주세요.
농도의 기본: 단위의 차이를 이해하자
중학교 교과서에서는 ‘질량 백분율 농도’가 주로 사용되지만, 실험 매뉴얼이나 논문에서는 ‘몰 농도’가 일반적입니다. 그래서 이 두 가지 농도를 자유자재로 변환하는 방법을 익혀볼 거예요. 계산 방법을 알면 정말 편리하고, 무엇보다 안심이 되겠죠?
질량 백분율 농도와 몰 농도는 기본적인 개념은 같아요.
용질 (녹아있는 물질) ÷ 용액 (전체)
다른 점은 바로 그 ‘단위’뿐입니다. 질량 백분율 농도는 질량(g) 으로 계산해요.
용질 (g) ÷ 용액 (g)
반면, 몰 농도는 화학 반응의 ‘입자 수’에 주목해서 몰(mol) 과 부피(L) 를 사용합니다.
용질 (mol) ÷ 용액 (L)
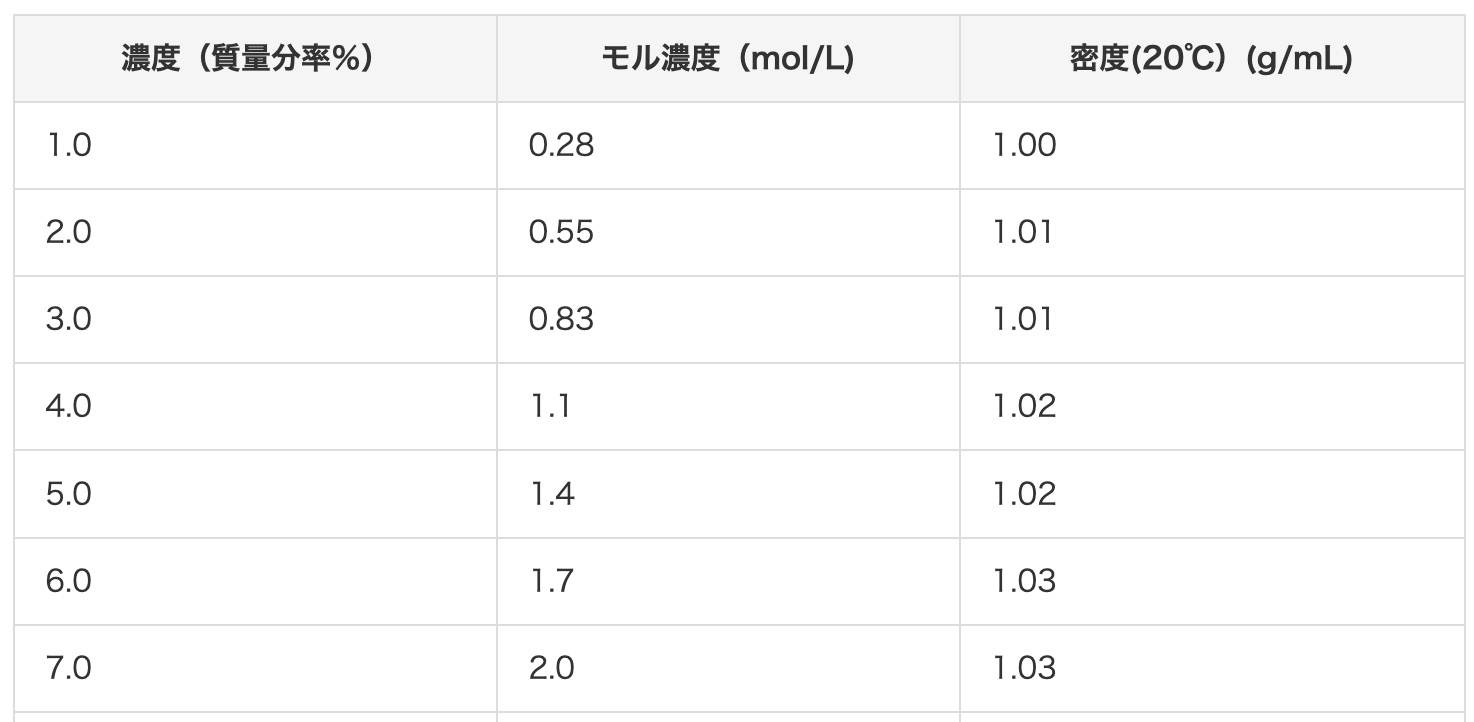
자, 그럼 2 mol/L 염산을 질량 백분율 농도로 바꿔 볼까요? 이 사이트의 참고 표를 보면, 2 mol/L 염산은 약 7%라고 하네요. 정말 그렇게 나오는지 계산으로 확인해 봅시다!
실전! 몰 농도에서 질량 백분율 농도로
먼저 계산에 필요한 정보를 모아볼게요. 염산(HCl)의 분자량은 각 원자의 무게를 더합니다. 수소(H)가 1, 염소(Cl)가 35.5이므로, 1 + 35.5 = 36.5가 됩니다. 염산(2mol/L)의 밀도는 자료에 따르면 1.03 g/cm³입니다. 이는 1 cm³당 1.03 g의 무게가 나간다는 뜻이죠.
이제 용액 1 L를 기준으로 계산해 볼게요.
용질: 2 mol ⟶ 2 × 36.5 = 73 g
용액: 1 L = 1000 cm³ ⟶ 1000 × 1.03 g/cm³ = 1030 g
용액 1 L (1030 g)에 염화수소가 73 g 녹아있다는 것을 알았어요. 이것을 질량 백분율 농도 공식에 대입하면…
73 (g) ÷ 1030 (g) = 0.070… 즉, 약 7%!
참고 표의 값과 정확하게 일치했네요!
거꾸로도 해보자! 질량 백분율 농도에서 몰 농도로
이번에는 반대 계산에 도전해 볼까요? 단위를 하나씩 변환하면 반드시 원래대로 돌아올 수 있습니다. 예를 들어, 7% 염산(밀도 1.03 g/mL)의 몰 농도를 구해봅시다. 몰 농도는 ‘용액 1 L에 용질이 몇 mol 녹아있는지’가 중요해요.
먼저, 용액 1 L의 무게를 계산합니다.
용액 1 L = 1000 mL ⟶ 1000 mL × 1.03 g/mL = 1030 g
이 중 7%가 용질(염화수소)의 무게이므로,
용질 1030 g × 0.07 = 72.1 g
마지막으로, 이 용질의 무게를 몰로 변환합니다. 염화수소의 분자량 36.5로 나누면,
72.1 (g) ÷ 36.5 (g/mol) ≒ 1.97 (mol)
용액 1 L에 1.97 mol이 녹아있으므로, 농도는 약 2 mol/L가 됩니다. 이것도 정확히 들어맞네요!
편리한 계산 도구
자주 사용하는 약품인 염산과 수산화나트륨의 경우, 농도 변환 소프트웨어를 만들어주신 분이 계시네요. 여기에서 검산해 보는 것도 좋겠죠.
https://keisan.casio.jp/menu/person/TaikiIkekame
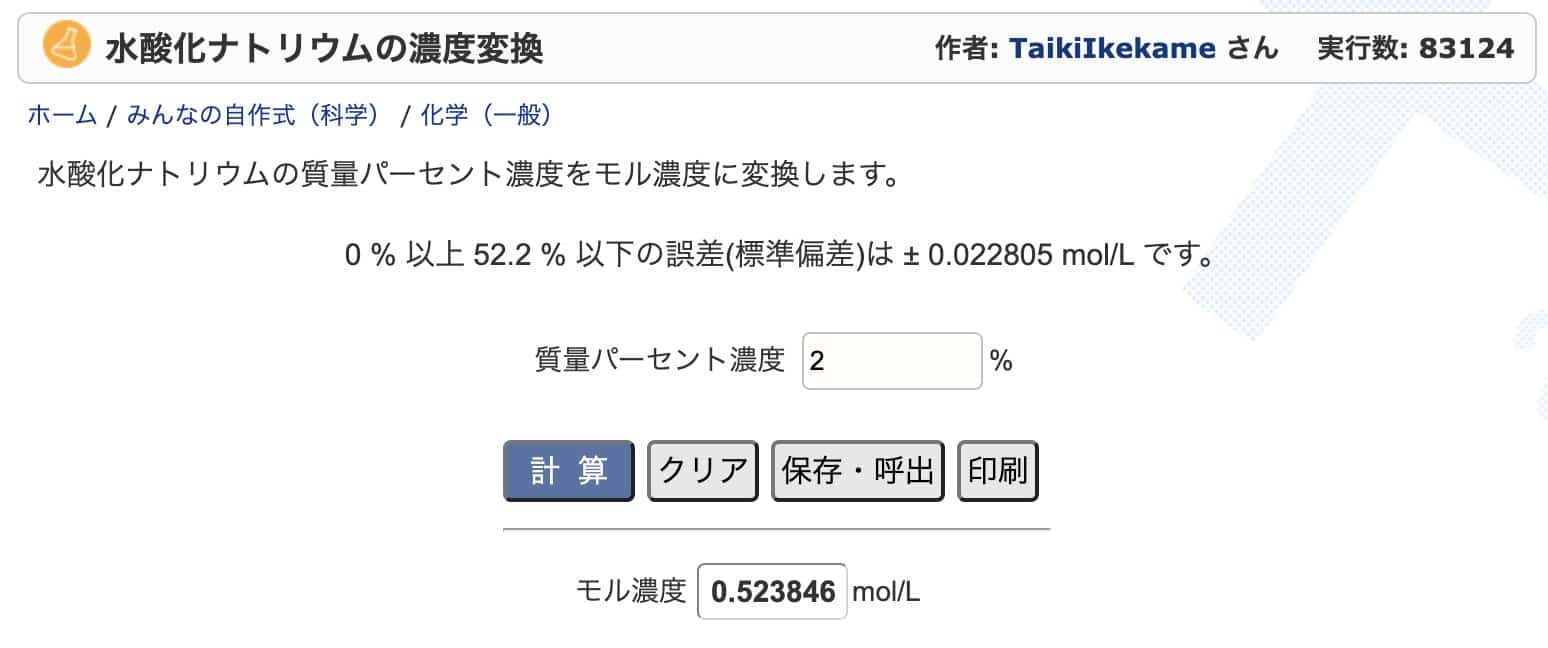
예를 들어 염산의 경우, 이 사이트에 ‘7%’를 입력하고 계산하면 ‘1.981 mol/L’라는 정확한 값이 바로 나옵니다.
https://keisan.casio.jp/exec/user/1480248881

[깨알 지식 ①] 염산과 염화수소, 뭐가 다를까?
자주 헷갈리지만, ‘염화수소(HCl)’는 상온에서 기체입니다. 그 염화수소가 물에 녹아있는 것을 ‘염산’이라고 부르죠. 사실 우리 위 속에 있는 위산도 이 염산이 주성분으로, 음식물 소화를 돕는 역할을 한답니다. ‘염화수소 HCl = 염소 Cl’는 절대 아니라는 점, 주의하세요!
[깨알 지식 ②] 규정농도(N)란?
‘규정농도(N)’라는 단위도 있어요. 이것은 몰 농도에 산이나 알칼리가 가진 ‘힘의 수(가수)’를 곱한 값입니다. 예를 들어 염산(HCl)은 힘이 1(1가)이므로, 1 mol/L라면 규정농도도 1 N입니다. 반면, 황산(H₂SO₄)은 힘이 2(2가)이므로, 1 mol/L라면 규정농도는 2 N가 됩니다. 산이나 알칼리 반응의 세기를 직관적으로 비교하고 싶을 때 편리한 단위죠. 더 자세한 내용은 여기를 참고해 주세요.
[깨알 지식 ③] ppm은 얼마나 작은 단위일까?
‘ppm’은 ‘100만분의 1’을 의미하는 단위로, “parts per million”의 약자입니다. 퍼센트가 100분율인 반면, ppm은 100만분율이죠. 아주 미세한 농도를 나타낼 때 사용됩니다.
용질의 질량(mg) / 용액의 질량(kg)
용액 1 kg (1000 g) 안에 겨우 1 mg의 용질이 녹아있는 상태가 1 ppm입니다.

이게 얼마나 작은지 감이 잘 안 오신다고요?
- 1톤 무게 속에 단 1g
- 100만 원 중에 단 1원
- 어떤 연구 모임에서 들은 얘기인데, 세뱃돈 연하장 1등에 당첨될 확률이 대략 1 ppm이라고 하네요! (직접 찾아봤어요)
이렇게 생각하면 ppm이 정말 어마어마하게 작은 비율이라는 것을 확실히 느낄 수 있죠.
연습 문제: 수산화나트륨으로 바꿔보자
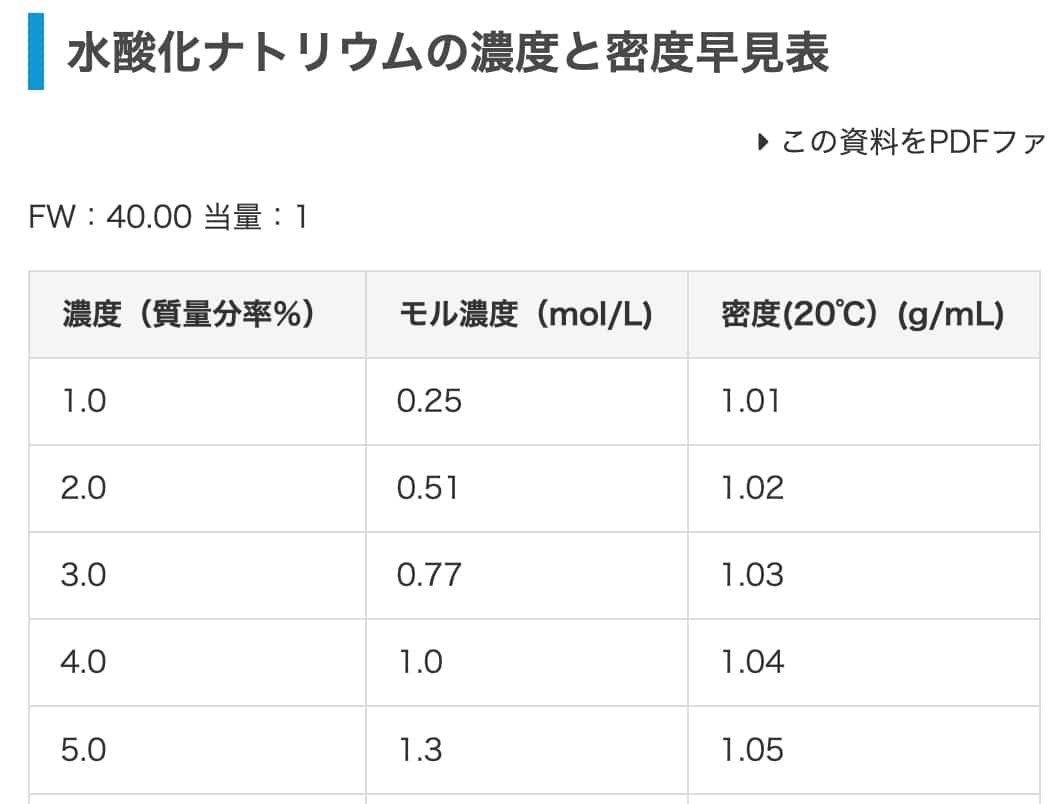
마지막으로 수산화나트륨으로 연습해볼게요. 2% 수산화나트륨 수용액을 몰 농도로 바꿔봅시다. 이 표를 참고하면 밀도는 1.02 g/mL입니다(글에 있던 1.03g/mL는 염산의 값이므로, 여기서는 이 값으로 계산할게요). 답은 0.51 mol/L가 나와야 합니다.
먼저, 용액 1 L의 질량을 계산합니다.
1000 mL × 1.02 g/mL = 1020 g
이 중 2%가 용질의 양이므로,
1020 g × 0.02 = 20.4 g
이것을 몰로 변환합니다. 수산화나트륨(NaOH)의 분자량은 40이므로,
20.4 g / 40 (g/mol) = 0.51 mol
결과는 1 L당 0.51 mol, 즉 몰 농도는 0.51 mol/L가 됩니다. 표의 값과 완벽하게 일치했네요!
이 사이트에서 계산해 봐도 거의 똑같이 나옵니다.
수산화나트륨 농도 변환: https://keisan.casio.jp/exec/user/1480256880
참고
중학교에서 많이 사용하는 염산은 진한 염산을 한 번에 희석해서 사용하는 것이 편리합니다. 예를 들어, 10% 염산을 만들려면 부피 비율로 진한 염산 1에 물 3.2를 더하면 됩니다. 500 cm³의 진한 염산을 모두 10%로 만들려면 1600 cm³의 물로 희석하면 되므로, 3리터짜리 폴리에틸렌 용기(amazon) 등에 희석해서 보관하면 좋아요.
|
|
문의 및 의뢰에 관하여
과학의 신기함과 재미를 더 가까이에서 느껴보세요! 집에서도 할 수 있는 재미있는 과학 실험과 그 노하우를 알기 쉽게 정리해 두었습니다. 이것저것 검색해 보세요!
・운영자 쿠와코 켄에 대해서는 여기
・각종 의뢰(집필, 강연, 실험 교실, TV 자문, 출연 등)는 여기
・새 글 소식은 X에서 배포 중!
![]() 과학 꿀팁 채널에서 실험 영상을 배포 중!
과학 꿀팁 채널에서 실험 영상을 배포 중!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)