Lyijytäytekynän grafiitti elektroidina!? Seuraa kemiallisia muutoksia “kupari(II)kloridin sähkölyysissä” (ekologista mikrokokeilua!)
Olen Ken Kuwako, tiedekouluttaja. Joka päivä on koe.
Mitä teille tulee mieleen, kun puhutaan luonnontieteen kokeista? Ehkä ajattelette riveittäin aseteltuja dekantterilaseja ja erlenmeyerpulloja, sekä monia vaikean näköisiä kemikaaleja… Mutta itse asiassa on olemassa tapa, jolla päästään tieteen ytimeen helpommin ja ympäristöystävällisemmin.
Tänään esittelen teille yläkoulun luonnontieteistä tutun ilmiön, kupari(II)kloridin elektrolyysin, joka suoritetaan käyttämällä hämmästyttävän pientä koevälinettä ( #mikrolevy ) – tämä on #mikroskaalakoe. Tämä ei ole vain sähkön johtamista. Kaunis sininen liuos muuttuu ”läpinäkyväksi”, ja esiin tulee ”metalli”, jota ei pitäisi näkyä… Voit seurata tätä maagista kemiallista muutosta aivan silmiesi edessä!
Pienen laboratorion, ”mikroskaalan”, viehätys
Tekemämme #mikroskaalakoe on menetelmä, jota käytettiin jo koulussa, jossa olin aiemmin töissä. Koska kemikaalien ja veden määrä pidetään minimissä, kokeen jälkeen syntyvän ”jätenesteen” määrää voidaan vähentää dramaattisesti. Suurin etu on se, että kokeesta nauttiminen on turvallista, ja valmistelevat toimet sekä siivoaminen ovat helppoja, samalla kun huomioidaan ympäristöä.
Juuri pienen skaalan takia muutokset ilmestyvät nopeasti, mikä tekee niistä täydellisiä havainnointiin. Jos haluat tietää enemmän mikroskaalakokeista, tutustu tähän artikkeliin. Siinä kerrotaan yksityiskohtaisesti kokeesta ja siitä, kuinka kuparikloridiliuos valmistetaan.
Tästä artikkelista löytyy yksityiskohtaista tietoa mikroskaalakokeista
Tässä on kuva todellisesta kokeesta. Katso ensin video!
Kokeen valmistelu ja ”ahaa!”-niksit
Kokeessa käytettävä kupari(II)kloridiliuos on sinistä nestettä. Luonnontieteellisissä kokeissa kemikaalit valmistetaan laskemalla tarkasti niiden pitoisuus.
【10 % kupari(II)klorididihydraattiliuoksen valmistusmenetelmä】
Kupari(II)klorididihydraatti CuCl2・2H2O Kaava massa = 170.48
Kun valmistetaan 10 % liuos, punnitaan määrä, joka vastaa 10 g ilman hydraattivettä. Koska CuCl2 = 63.5 + 35 × 2 = 133.5 ja 2H2O = 2 × 18 = 36,
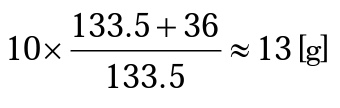
Siksi lisätään 13 g kupari(II)klorididihydraattikiteitä veteen, jotta liuos painaa 100 g.
Tässä tuli esiin hieman erikoislaskentaa, joka on tarpeen, kun liuoksessa on ”hydraattivettä” (kiteeseen sitoutunutta vettä). Onneksi, tähän kokeeseen kuparikloridin pitoisuus voi olla matalampikin (3 prosenttia on riittävä). Artikkelissa puhutaan 4 cm³ per solu (koekolo), mutta vertailun vuoksi valmistin myös 1 cm³ liuoksen.
Muuten, jos koulu suorittaisi kokeen 10 ryhmässä (4 hengen ryhmät, eli 40 oppilasta), tarvittaisiin vain 1 ryhmäannos (4 cm³) × 10 = 40 cm³. Neljälle luokalle yhteensä tarvittaisiin vain 160 cm³ (noin 1/6 maitopurkista). Aika ekologista, eikö?



(Valmistin tällä kertaa hieman enemmän, koska halusin suorittaa myös vertailukokeita)

Koejärjestely ja turvallisuusniksit
Kokeen suorittaminen on yksinkertaista.
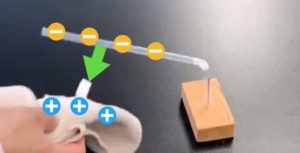
- Laita kupari(II)klorididihydraattiliuos soluun.
- Aseta hiilisauvaelektrodit paikalleen ja syötä 5V tasajännite.
- Tarkkaile muutoksia anodilla (+napa) ja katodilla (-napa).
- Tutki anodilla ja katodilla syntyneitä aineita.
Tässä on mielenkiintoinen kikka. Elektrodina käytettävä hiilisauva voidaan korvata niinkin erikoisella asialla kuin paksulla 2 mm:n lyijytäytekynän lyijyllä!

|
|
Lyijytäytekynän lyijy on valmistettu samasta aineesta kuin lyijykynän lyijy – hiilestä, ja se johtaa sähköä hyvin.
Tärkeää tässä on kuitenkin ”oikosulun estäminen”. Jos positiivinen ja negatiivinen napa koskettavat toisiaan liuoksessa, sähkö kulkee elektrodien välillä suoraan (oikosulku), eikä elektrolyysiä voida suorittaa oikein. Se on erittäin vaarallista. Siksi tein pienistä styroksin palasista jalustan elektrodien kiinnittämiseksi.


Vaikka styroksia ei olisi, on tärkeää avata elektrodit ”kahdeksikon muotoon” ja varoa ehdottomasti, etteivät ne kosketa toisiaan.

Kahdeksikko on avainasemassa
Piiri järjestettiin tällä tavalla, jotta kaksi koetta voidaan suorittaa samanaikaisesti yhdestä virtalähteestä. Jännite on 5 V.

Aloitetaan koe! Sininen liuos muuttuu täysin
Kiinnitetään elektrodit ja aloitetaan elektrolyysi!

Kun liuosta tarkkailee tiiviisti… muutos on havaittavissa heti. Katodille (–napa) alkaa kerääntyä ruskehtavaa ainetta. Ja anodilla (+napa) alkaa muodostua pieniä kuplia.

Kun jännitettä syötetään vielä noin kymmenen minuuttia… liuoksen niin kirkas sininen väri on kadonnut kokonaan ja muuttunut läpinäkyväksi! (*Voit käyttää noin 9 V jännitettä ajan lyhentämiseksi, mutta silloin on oltava vielä varovaisempi oikosulun suhteen!)
Mysteeri ratkeaa: Kadonneen ”sinisen” ja ilmestyneiden ”kuplien” todellinen luonne
Jatketaan tämän kummallisen muutoksen syyn selvittämistä. Ensinnäkin, liuoksen ”sininen väri” johtuu kupari-ioneista (Cu2+). Kun kupari(II)kloridi (CuCl2) liukenee veteen, se hajoaa kupari-ioneiksi (Cu2+) ja kloridi-ioneiksi (Cl–).
【Muutos katodilla (–napa)】
Katodille (–napa) hakeutuu positiivisesti varautunut kupari-ioni (Cu2+). Se vastaanottaa virtalähteestä tulevan elektronin (e–) ja muuttuu sähköisesti neutraaliksi kuparimetalli-atomiksi (Cu). Tämä on se ruskea aine, joka tarttui elektrodiin! Koska siniset ”kupari-ionit” muuttuivat liuoksessa yhä enemmän ”kuparimetalliksi”, liuoksen väri katosi ja siitä tuli läpinäkyvä.
【Muutos anodilla (+napa)】 Anodille (+napa) hakeutuu negatiivisesti varautunut kloridi-ioni (Cl–). Se menettää elektronin (e–) ja muuttuu kloorikaasuksi (Cl2). Ne pienet kuplat olivat siis klooria, joka tunnetaan uima-altaiden desinfiointiaineen hajusta!
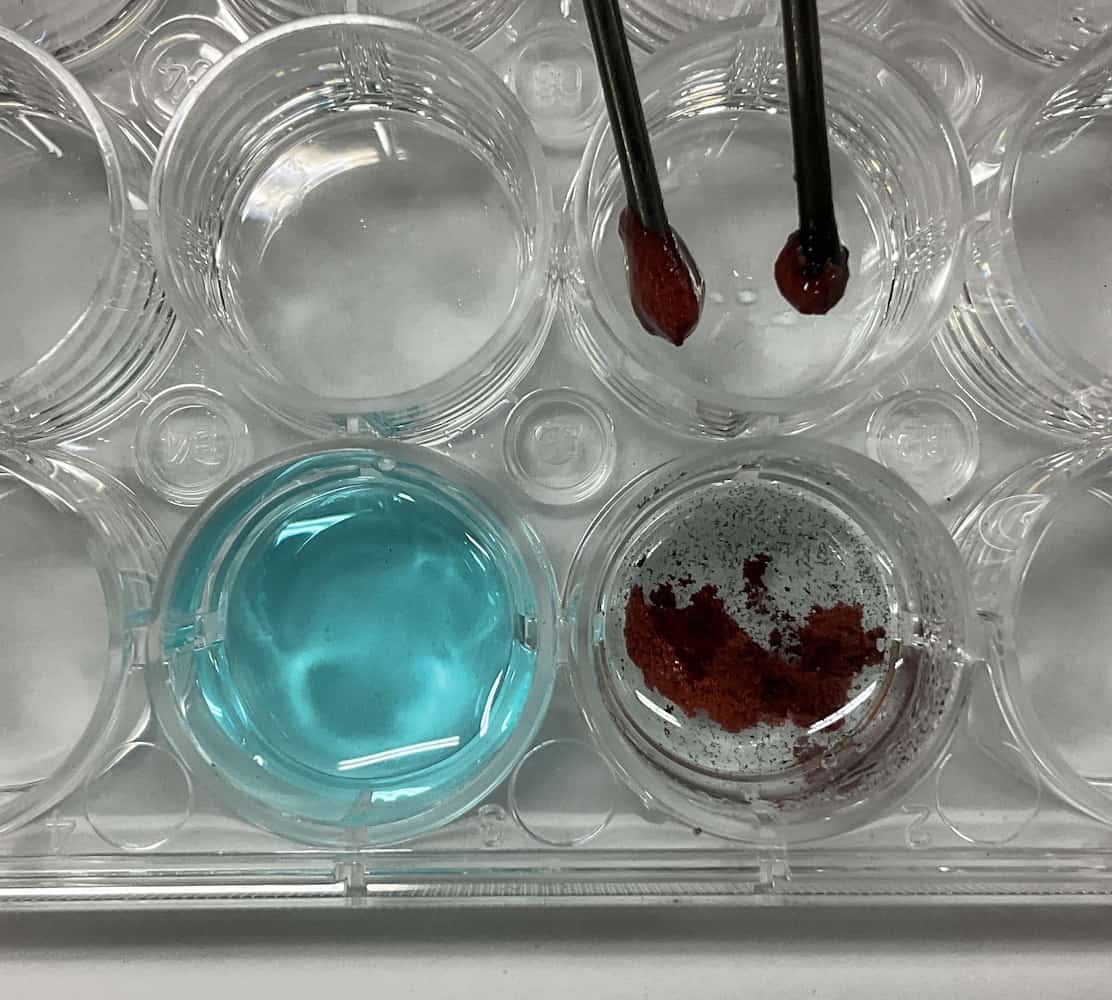
Kloorilla on ”valkaiseva vaikutus”, eli se kykenee poistamaan värejä. Pyysin oppilaita kokeilemaan kloorin tunnistamista vapaasti. Osa ryhmistä testasi värireaktion asettamalla anodin lähelle suodatinpaperin, johon oli tiputettu vesiliukoista (punaista) mustetta. Osa kasti suodatinpaperin liuokseen, ja osa laittoi viereiseen soluun vettä ja mustetta ohjatakseen kuplat sinne. Menetelmiä oli monia.


Vesiliukoisen musteen lisäksi huomasimme, että vihreän huomiokynän käyttäminen teki värimuutoksesta erittäin selkeän! Tämäkin oli mielenkiintoinen löytö.

Tieteen laajenevat yhteydet
Koe ei pääty tähän. Katodille (–napa) tarttunutta kuparia voi hioa lusikalla suodatinpaperin päällä, ja se alkaa hehkua kirkkaalla metallin kiillolla. Lisäksi yksi ryhmä käytti kaasupoltinta liuoksen ja tarttuneen kuparin polttamiseen ja tarkisti ”liekin värireaktion”.
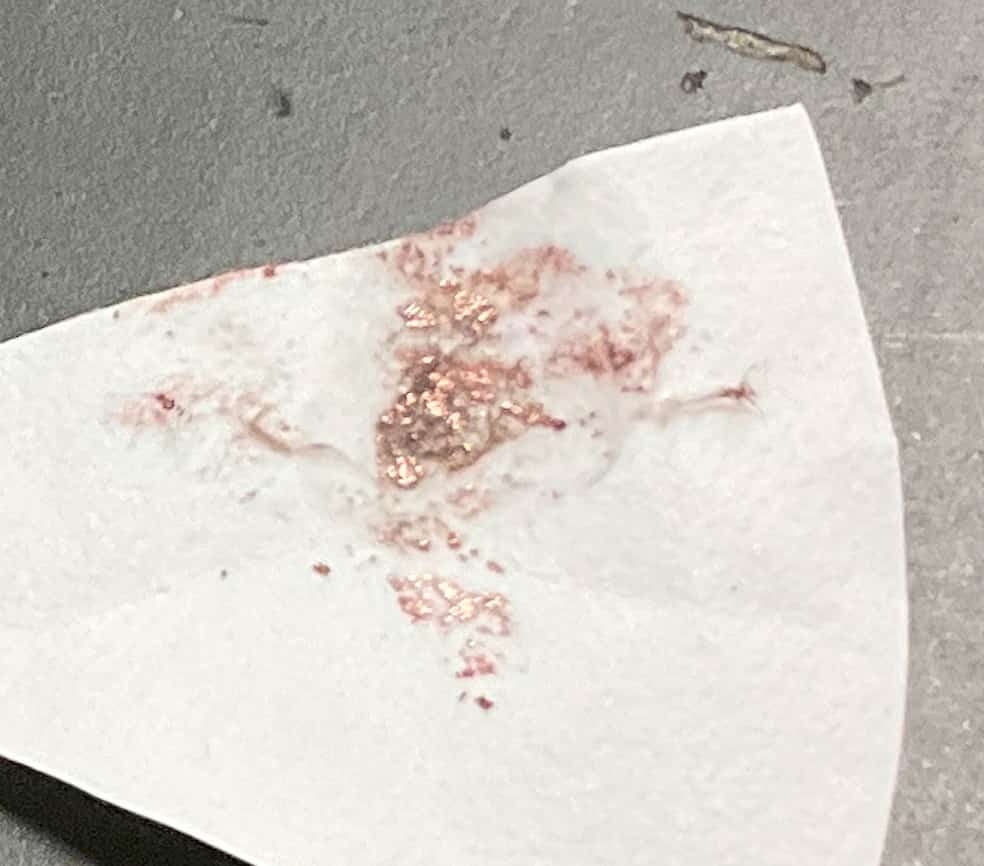
Kupari palaa liekissä sinivihreällä värillä. Tämä on sama periaate, jota käytetään ilotulitteiden värien luomiseen. Erilaisten menetelmien avulla varmistetaan, että itse erotettu aine on todella kuparia… Se on tieteen todellinen hienous. Sen sijaan, että vain muistetaan sana ”elektrolyysi”, kemian mielenkiintoisuus syvenee, kun koetaan hetki, jolloin aineet muuttuvat silmien edessä, värit katoavat ja uusia aineita syntyy. Se on todella hauska koe, jossa tehdään monia löytöjä. Ostin myös tämän kirjan mikroskaalakokeista.
Tiedustelut ja pyynnöt
Tuo tieteen ihmeet ja mielenkiintoisuus lähemmäksi! Olen koonnut selkeästi hauskoja kokeita, jotka voi tehdä kotona, ja vinkkejä niiden suorittamiseen. Kokeile hakea lisää! ・Tietoa ylläpitäjä Ken Kuwakosta löytyy täältä ・Erilaiset pyynnöt (kirjoittaminen, luennot, kokeelliset luokat, TV-konsultaatiot, esiintymiset jne.) täältä ・Artikkelipäivitykset lähetetään X:ssä!
![]() Tieteen Aiheiden Kanava julkaisee koevideoita!
Tieteen Aiheiden Kanava julkaisee koevideoita!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しまseは、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c4b1d07.ce019e28.2c4b1d08.6132124d/?me_id=1208593&item_id=10346879&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Farde%2Fcabinet%2Fitem654%2F5312487_1.jpg%3F_ex%3D240x240&s=240x240&t=picttext)