【Ei enää sekaannuksia!】 Kemian resepti massaprosenttipitoisuuden ja molaarisuuden helppoon muuntamiseen (Normaliteetti N · ppm)
Olen tiedekouluttaja Ken Kuwako. Jokainen päivä on kokeilu.
Oletko koskaan miettinyt, paljonko on ”suolaa ripaus”, kun luet ruokaohjetta? Kemian maailmassa on itse asiassa monia tapoja ilmaista ”väkevyys”, ja tiedemiehet käyttävät niitä tilanteen mukaan. Tällä kertaa sukellamme kahden ”väkevyyden” yksikön, koulun kokeista tutun massaprosenttipitoisuuden ja ammattimaisemman moolitilavuuspitoisuuden, väliseen maailmaan. Kun osaat nämä laskut, kemian maailma tuntuu heti paljon läheisemmältä ja kokeet ovat hauskempia ja turvallisempia!
Löydät ohjeet laimentamiseen täältä.
Pitoisuuden perusteet: ymmärrä yksiköiden erot
Koulukirjoissa käytetään usein massaprosenttipitoisuutta, mutta laboratorion oppaissa ja tieteellisissä julkaisuissa moolitilavuuspitoisuus on yleisempi. Hallitsemalla näiden kahden yksikön muuntamisen olet valmis kaikkeen. Laskin kädessä on aina turvallista ja kätevää!
Perusajatus on sama molemmissa pitoisuuksissa.
Liuenneen aineen määrä ÷ koko liuos
Ainoa ero on niiden ”yksiköissä”. Massaprosenttipitoisuudessa käytetään massaa (g).
Liuenneen aineen massa (g) ÷ liuoksen massa (g)
Moolitilavuuspitoisuudessa puolestaan keskitytään hiukkasten määrään käyttäen mooleja (mol) ja tilavuutta (L).
Liuenneen aineen määrä (mol) ÷ liuoksen tilavuus (L)
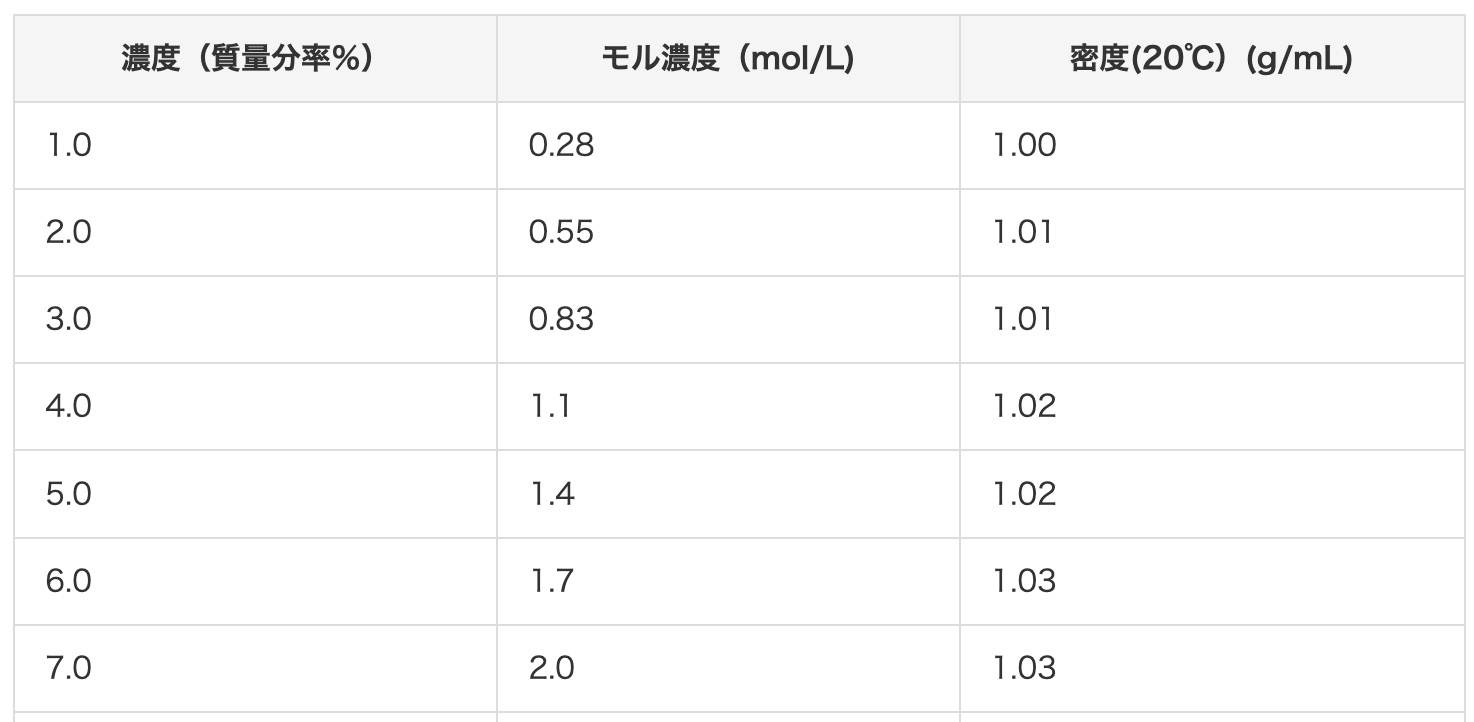
Muunnetaan seuraavaksi 2 mol/L suolahappoa massaprosenttipitoisuudeksi. Tämän sivun pikataulukon mukaan 2 mol/L suolahappo on noin 7-prosenttista. Tarkistetaan laskemalla, pitääkö se paikkansa!
Käytäntöön! Moolitilavuuspitoisuudesta massaprosenttipitoisuuteen
Ensin kerätään laskentaan tarvittavat tiedot. Suolahapon (HCl) molekyylipaino: Lisätään atomien painot yhteen. Vety (H) on 1 ja kloori (Cl) on 35,5, joten 1 + 35,5 = 36,5. Suolahapon (2 mol/L) tiheys: Tietojen mukaan se on 1,03 g/cm³. Tämä tarkoittaa, että 1 cm³ painaa 1,03 g.
Otetaan laskentaan referenssiksi 1 L liuosta.
Liuenneen aineen määrä: 2 mol ⟶ 2 × 36,5 = 73 g
Liuos: 1 L = 1000 cm³ ⟶ 1000 × 1,03 g/cm³ = 1030 g
Olemme saaneet selville, että 1 L:aan liuosta (1030 g) on liuennut 73 g vetykloridia. Sijoitetaan tämä massaprosenttipitoisuuden kaavaan…
73 (g) ÷ 1030 (g) = 0,070… eli noin 7 %!
Tulos osuu hienosti yksiin pikataulukon arvon kanssa!
Kokeillaan toisin päin! Massaprosenttipitoisuudesta moolitilavuuspitoisuuteen
Nyt yritämme kääntää laskutoimituksen. Kun muunnat yksiköt yksi kerrallaan, pääset takaisin alkuun. Otetaan esimerkiksi 7 % suolahappo, jonka tiheys on 1,03 g/mL, ja lasketaan sen moolitilavuuspitoisuus. Avain tähän on selvittää, kuinka monta moolia liuenneen aineen määrää on liuennut 1 L:aan liuosta.
Ensin lasketaan 1 L liuoksen paino.
Liuos 1 L = 1000 mL ⟶ 1000 mL × 1,03 g/mL = 1030 g
Koska tästä 7 % on liuenneen aineen massaa,
Liuenneen aineen massa 1030 g × 0,07 = 72,1 g
Lopuksi, muunnetaan liuenneen aineen massa mooleiksi. Kun se jaetaan vetykloridin molekyylipainolla 36,5, saadaan
72,1 (g) ÷ 36,5 (g/mol) ≒ 1,97 (mol)
Koska 1 L:aan liuosta on liuennut 1,97 moolia, pitoisuus on noin 2 mol/L. Tulos on täydellinen!
Kätevät laskurit
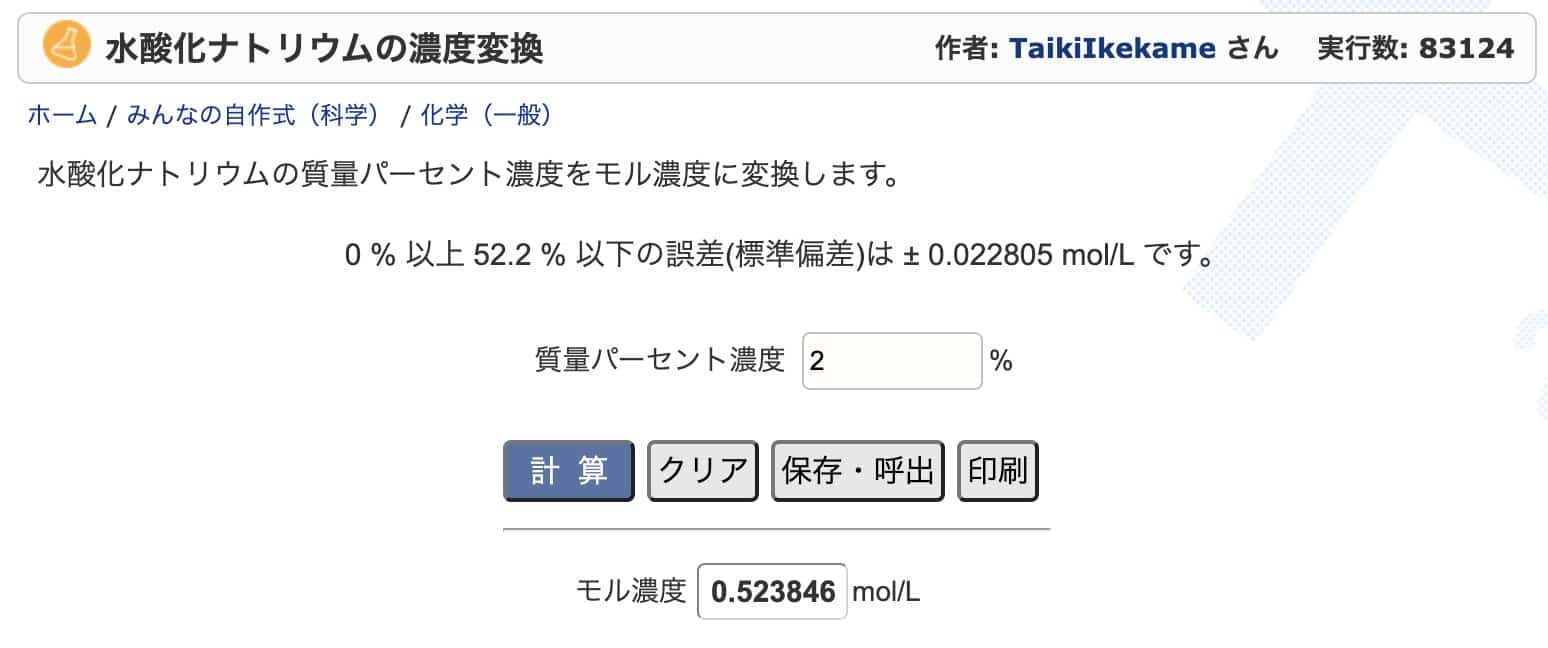
Suolahapolle ja natriumhydroksidille, joita käytetään usein, näyttää olevan olemassa pitoisuusmuunnosohjelmia. Voit käyttää niitä tarkistukseen.
https://keisan.casio.jp/menu/person/TaikiIkekame
Esimerkiksi suolahapon osalta voit kirjoittaa sivulle ”7 %” ja se antaa tarkan arvon ”1,981 mol/L”.
https://keisan.casio.jp/exec/user/1480248881

【Tietoisku ①】 Mikä on suolahapon ja vetykloridin ero?
Nämä kaksi sekoitetaan usein, mutta ”vetykloridi (HCl)” on huoneenlämmössä kaasu. ”Suolahappo” on sen veteen liuennut muoto (vesiliuos). Itse asiassa mahassamme olevan mahahapon pääainesosa on suolahappo, joka auttaa sulattamaan ruokaa. Huomaa, että ”vetykloridi HCl” ei missään nimessä ole sama kuin ”kloori Cl”.
【Tietoisku ②】 Mikä on normaliteetti (N)?
On olemassa myös yksikkö nimeltä ”normaliteetti (N)”. Se saadaan kertomalla moolitilavuuspitoisuus kyseisen hapon tai emäksen ”voiman numerolla” eli ekvivalenttiluvulla. Esimerkiksi suolahapon (HCl) ekvivalenttiluku on 1, joten 1 mol/L vastaa 1 N. Toisaalta rikkihapon (H₂SO₄) ekvivalenttiluku on 2, joten 1 mol/L on 2 N. Se on kätevä yksikkö, kun halutaan vertailla happojen ja emästen reaktiivisuutta intuitiivisesti. Lisätietoja löydät täältä.
【Tietoisku ③】 Paljonko on ppm?
”ppm” on lyhenne sanoista ”parts per million”, eli ”miljoonasosa”. Siinä missä prosentti on sadasosa, ppm on miljoonasosa. Sitä käytetään ilmaisemaan hyvin pieniä pitoisuuksia.
Liuenneen aineen massa (mg) / liuoksen massa (kg)
1 ppm tarkoittaa, että 1 kg:ssa (1000 g) liuosta on liuennut vain 1 mg liuenneen aineen määrää.

Kuinka pieni tämä oikeastaan onkaan…
- Vain 1 g tonnin painossa
- Vain 1 euro senttiä miljoonaan euroon verrattuna
- Kuulin eräässä seminaarissa, että vuoden alussa lähetettävien uuden vuoden postikorttien pääpalkinnon voittamisen todennäköisyys on noin 1 ppm! (Tarkistin asian)
Näin ajateltuna voi todella ymmärtää, kuinka uskomattoman pienestä suhteesta on kyse.
Harjoitustehtävä: Muunnetaan natriumhydroksidilla
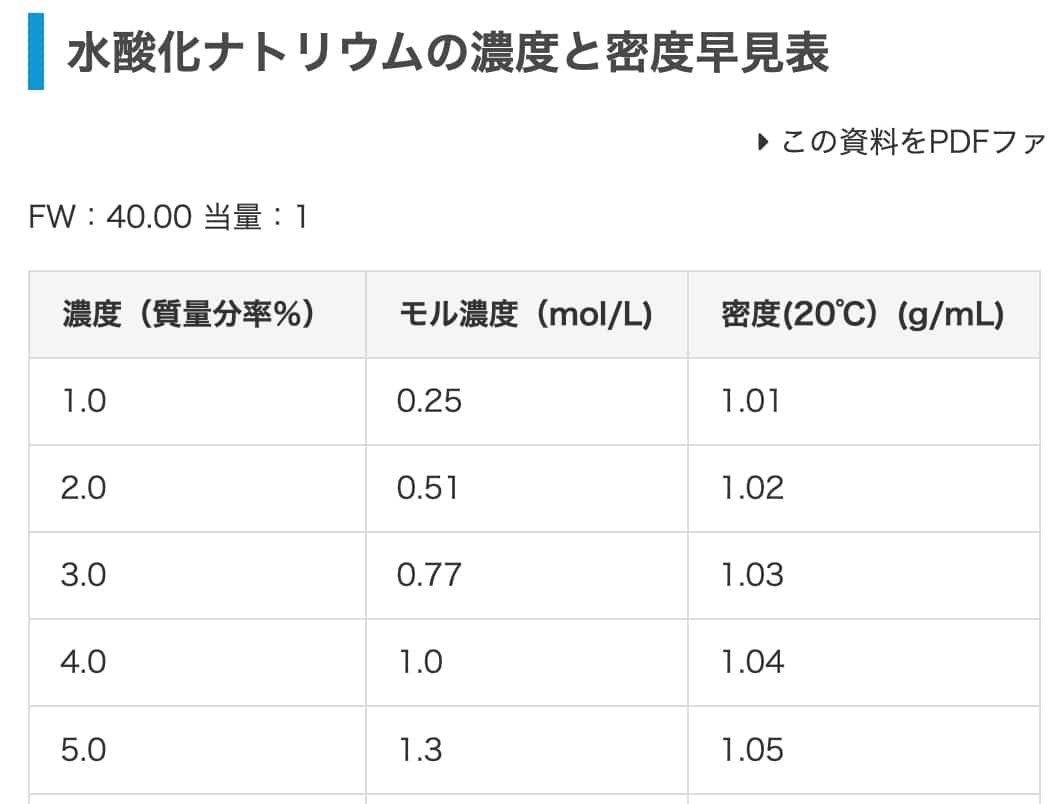
Lopuksi harjoitellaan natriumhydroksidilla. Muunnetaan 2-prosenttinen natriumhydroksidiliuos moolitilavuuspitoisuudeksi. Tämän taulukon mukaan tiheys on 1,02 g/mL (koska artikkelin 1,03 g/mL arvo on suolahapolle). Vastauksen pitäisi olla 0,51 mol/L.
Lasketaan ensin 1 L liuoksen massa.
1000 mL × 1,02 g/mL = 1020 g
Koska 2 % tästä on liuenneen aineen määrä,
1020 g × 0,02 = 20,4 g
Muunnetaan tämä mooleiksi. Natriumhydroksidin (NaOH) molekyylipaino on 40, joten
20,4 g / 40 (g/mol) = 0,51 mol
Ja koska se on 0,51 mol per 1 L, moolitilavuuspitoisuus on 0,51 mol/L. Hienosti se täsmää taulukon arvoon!
Tämä laskuri antaa saman tuloksen.
Natriumhydroksidin pitoisuusmuunnin: https://keisan.casio.jp/exec/user/1480256880
Viitteet
Suolahappo, jota käytetään paljon kouluissa, on kätevä laimentaa väkevästä suolahaposta. Esimerkiksi 10-prosenttisen suolahapon valmistamiseksi, väkevään suolahappoon suhteessa 1:3,2 lisätään vettä. Jos kaikki 500 cm³ väkevää suolahappoa halutaan muuntaa 10-prosenttiseksi, se pitäisi laimentaa 1600 cm³ vedellä, ja se on hyvä säilyttää esimerkiksi 3 litran polyeteenisäiliössä (amazon).
|
|
Yhteydenotot ja tiedustelut
Haluan tehdä tieteen ihmeistä ja hauskuudesta helpommin lähestyttäviä! Olen koonnut tänne yksinkertaisia ja hauskoja tiedekokeita, joita voi tehdä kotona. Etsi lisää tietoa!
・Tietoa minusta, Ken Kuwakosta, löydät täältä
・Erilaisia tiedusteluja (kirjoittaminen, luennot, tiedekerhot, TV-konsultointi, esiintyminen jne.) varten ota yhteyttä täällä
・Päivitän uusia artikkeleita X:ssä!
![]() Tieteen temppukanava jakaa kokeiluvideoita!
Tieteen temppukanava jakaa kokeiluvideoita!
2月のイチオシ実験!梱包材で遊ぼう!
- 静電気の時期になってきました。子供と一緒に梱包材で盛り上がろう!→ やめられなくなる!静電気実験20
 体中に梱包材をはりつけてみよう!
体中に梱包材をはりつけてみよう!
テレビ番組等・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師等・ショー・その他お知らせ
- 2/20(金)「生徒の進学希望実現支援事業」研究授業@福井県立若狭高等学校 講師
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) サイエンスショー予定
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[商品価格に関しまley on, linkki on luotu ja nykyinen hinta saattavat olla erilaiset.] [商品価格に関しまley on, linkki on luotu ja nykyinen hinta saattavat olla erilaiset.]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)

