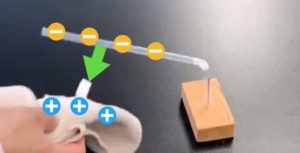
¿La mina del portaminas como electrodo? ¡Sigue los cambios químicos con la “electrólisis del cloruro de cobre” (experimento ecológico a microescala)!
Soy Ken Kuwako, tu entrenador de ciencias. ¡Cada día es un experimento!
Cuando escuchan “experimento científico”, ¿qué les viene a la cabeza? Tal vez una imagen de vasos de precipitados y matraces, con un montón de químicos que parecen complicadísimos. ¡Pero la verdad es que hay una forma mucho más sencilla, ecológica y accesible de ir al meollo de la ciencia!
Hoy les mostraré la “Electrólisis del cloruro de cobre”, un clásico de las clases de ciencias, pero que haremos usando un equipo de laboratorio increíblemente pequeño: el “Experimento a microescala” (#micropescala), utilizando una #microplaca. Este experimento es más que solo pasar electricidad. Verán cómo la hermosa solución acuosa de color azul se vuelve “transparente” y, de repente, aparece un “metal” que no estaba a la vista… ¡Podrán observar una transformación química casi mágica justo ante sus ojos!
El encanto del pequeño laboratorio: la “Microescala”
El “Experimento a microescala” (#microescala) que realizamos aquí es un método que incluso implementé en la escuela donde trabajaba antes. Al minimizar la cantidad de químicos y agua que se utilizan, se reduce drásticamente la “solución de desecho” (el desecho líquido) que queda después del experimento. El mayor atractivo es que, mientras cuidamos el medio ambiente, la preparación y la limpieza se vuelven muy sencillas, ¡y podemos disfrutar del experimento con total seguridad!
Precisamente por ser a una escala tan pequeña, los cambios a veces aparecen muy rápido, lo que lo hace perfecto para la observación. Si quieren saber más sobre los experimentos a microescala, ¡echen un vistazo a este artículo! En él encontrarán detallados los procedimientos del experimento y cómo preparar la solución de cloruro de cobre.
Aquí se detalla todo lo referente a los experimentos a microescala
Así es como se ve el experimento real. ¡Véanlo en este video primero!
Preparación del experimento y trucos ingeniosos
La “solución acuosa de cloruro de cobre” que usamos es un líquido de color azul. En los experimentos de ciencias, siempre preparamos las sustancias calculando con precisión la concentración (qué tan concentrada está) del químico.
【10%-塩化銅(Ⅱ)二水和物水溶液の調製法】
塩化銅(Ⅱ)二水和物 CuCl2・2H2O 式量=170.48
10%水溶液を調製する場合,水和水を除いて10gになる量をはかりとる。 CuCl2=63.5+35×2=133.5 2H2O=2×18=36 であるから,
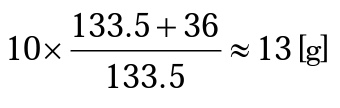
よって,13gの塩化銅(Ⅱ)二水和物結晶に水を加えて100gにする。
Parece un cálculo un poco técnico, pero es necesario cuando la solución contiene “agua de hidratación” (el agua incluida en el cristal). Sin embargo, la buena noticia es que, para este experimento, ¡la concentración de cloruro de cobre puede ser baja (incluso un 3% funciona)! El artículo menciona 4 cm3 por celda (agujero de experimento), pero nosotros también preparamos 1 cm3 para fines de comparación.
Por cierto, si se hiciera este experimento en una escuela con una clase de 40 estudiantes (10 grupos de 4 personas), solo se necesitarían 4 cm3 por grupo × 10 = 40 cm3. ¡Para cuatro clases enteras, solo se gastarían 160 cm3 (aproximadamente 1/6 de un cartón de leche)! ¡Realmente ecológico!



(Esta vez hicimos más porque queríamos realizar un experimento comparativo)

Método de experimento y soluciones de seguridad
El método experimental es simple:
- セルに塩化銅(Ⅱ)二水和物水溶液を入れる。
- 炭素棒電極を挿入し,5V直流電圧を印加する。
- 陽極(+極),陰極(-極)での変化を観察する。
- 陽極・陰極から発生したものについて調べる。
Aquí viene una solución ingeniosa y divertida. ¡La “barra de carbono” que usamos como electrodo puede sustituirse nada más y nada menos que por una mina de lápiz mecánico (portaminas) gruesa de 2mm!

Mina de lápiz mecánico de 2 mm
|
|
Las minas de lápiz mecánico están hechas del mismo “carbono” que las minas de lápiz, ¡y conducen muy bien la electricidad!
Sin embargo, un punto crucial aquí es la “prevención de cortocircuitos”. Si el electrodo positivo (+) y el negativo (-) se tocan dentro de la solución, la electricidad fluirá directamente entre los electrodos en lugar de a través de la solución (un cortocircuito), lo que impide la electrólisis correcta y es muy peligroso. Por eso, cortamos un pequeño trozo de poliestireno (corcho blanco) para crear una base que fije los electrodos.


Aunque no tengan poliestireno, es fundamental abrir los electrodos en forma de “letra ‘Ocho’ (/)” y tener mucho cuidado de que nunca se toquen.

La forma de ‘Ocho’ es la clave
El circuito se montó de esta manera, bifurcando la energía de una sola fuente para poder realizar dos experimentos simultáneamente. El voltaje es de 5V.

¡A experimentar! La solución azul se transforma
¡Colocamos los electrodos y empezamos la electrólisis!

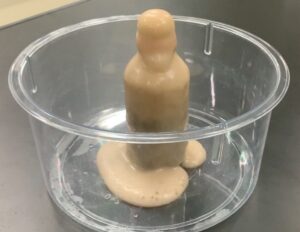
Al observar atentamente la solución, el cambio apareció de inmediato. Se puede ver que una sustancia de color marrón comienza a adherirse al cátodo (electrodo negativo, –). Y en el ánodo (electrodo positivo, +), comenzaron a formarse pequeñas burbujas.

Y después de aplicar el voltaje durante unos 10 minutos más… ¡El color azul tan intenso de la solución desapareció por completo y se volvió transparente! (Nota: Si quieres acortar el tiempo, puedes usar unos 9V, ¡pero debes tener aún más cuidado para evitar cortocircuitos!)
Capítulo de Misterios: La identidad del “Azul” que se fue y la “Burbuja” que apareció
Muy bien, vamos a desvelar el secreto de este misterioso cambio. Primero, el color “azul” de la solución se debe a las partículas llamadas “iones de cobre (Cu2+)”. Cuando el cloruro de cobre (CuCl2) se disuelve en agua, se separa en iones de cobre (Cu2+) e iones de cloruro (Cl–).
[Cambios en el cátodo (electrodo negativo, –)]
Los “iones de cobre (Cu2+)”, que tienen carga eléctrica positiva, son atraídos hacia el cátodo (electrodo negativo, –). Allí, reciben los electrones (e–) enviados por la fuente de alimentación y se transforman en átomos de “cobre (Cu)” eléctricamente neutros. ¡Esta es la identidad de la sustancia marrón adherida al electrodo! La razón por la que el color azul de la solución desapareció y se volvió transparente es porque los iones de cobre azules se convirtieron progresivamente en cobre sólido.
[Cambios en el ánodo (electrodo positivo, +)] Los “iones de cloruro (Cl–)”, que tienen carga eléctrica negativa, son atraídos hacia el ánodo (electrodo positivo, +). Allí, pierden un electrón (e–) y se convierten en gas “cloro (Cl2)”. ¡Así es! La identidad de esas pequeñas burbujas era el cloro, conocido por su olor a desinfectante de piscina.
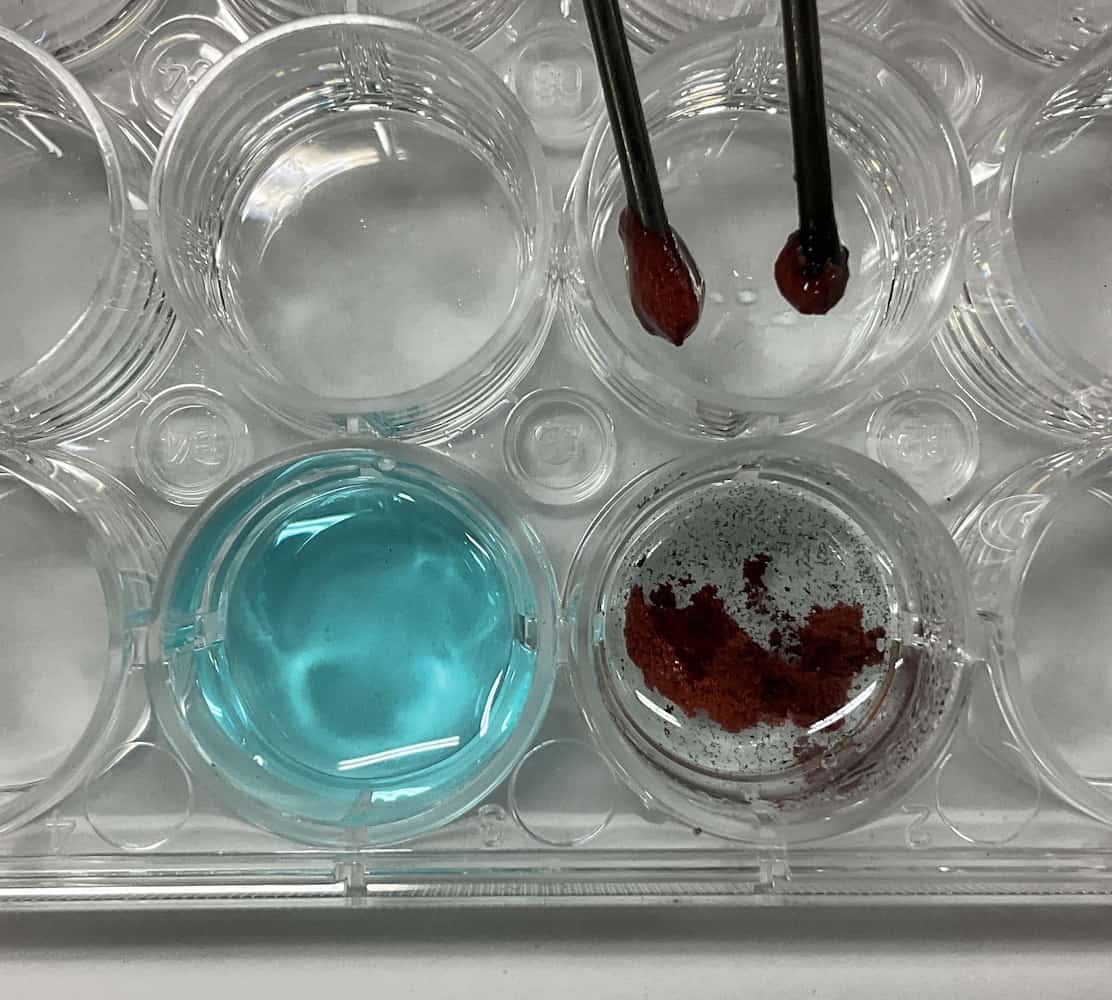
El cloro tiene un “efecto blanqueador” que hace desaparecer los colores. Pedimos a los estudiantes que intentaran confirmar la presencia de cloro libremente. Hubo grupos que gotearon tinta a base de agua (roja) en papel de filtro y lo colocaron cerca del ánodo para comprobar la reacción de decoloración, otros que sumergieron el papel de filtro en la solución, y otros que pusieron agua y tinta en una celda contigua para guiar las burbujas… ¡Cada grupo tuvo ideas diferentes!


Además de la tinta a base de agua, descubrimos que usar un rotulador fluorescente de color verde hace que el cambio de color sea muy fácil de ver. ¡Otro hallazgo interesante!

Ampliando las conexiones científicas
El experimento no termina aquí. El “cobre” que se adhirió al cátodo (electrodo negativo, –) se puede sacar sobre papel de filtro y, al frotarlo con una cuchara, se confirma que emite un brillo metálico resplandeciente. Además, un grupo utilizó un mechero Bunsen para quemar la solución acuosa y el cobre adherido, verificando la “reacción a la llama”.
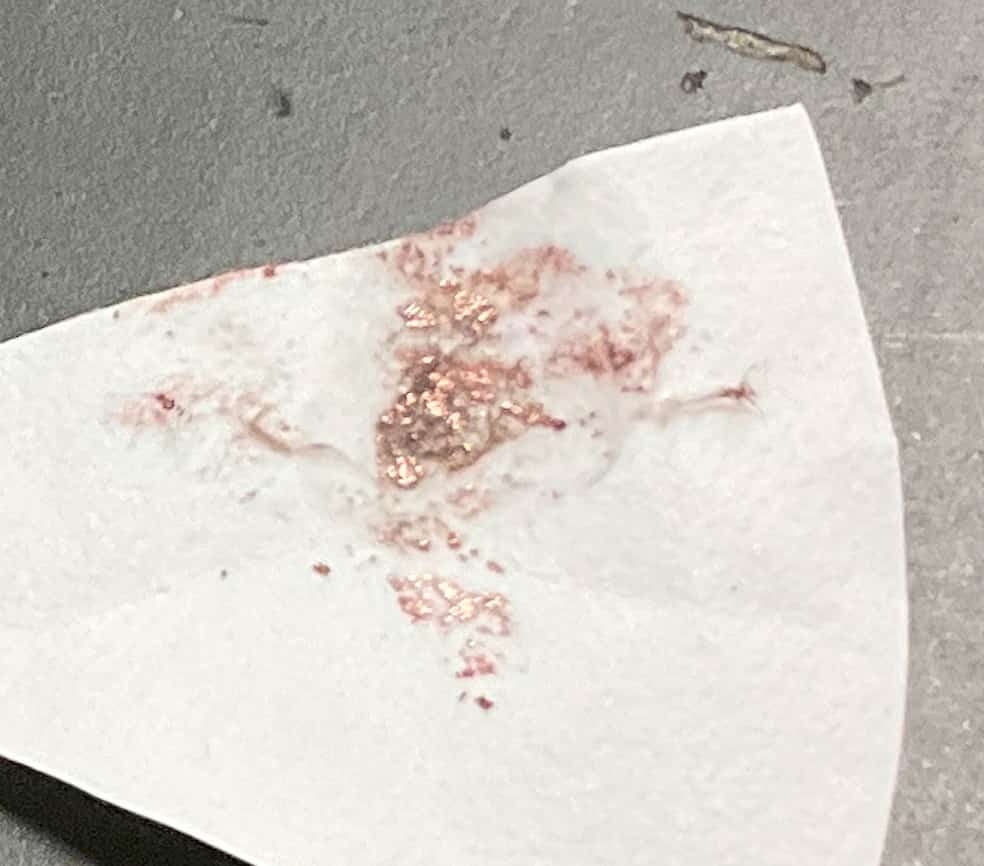
Cuando el cobre se expone a una llama, produce una llama de color verde azulado, el mismo principio que se utiliza para dar color a los fuegos artificiales. Comprobar, de varias maneras, que la sustancia que tú mismo has extraído es realmente “cobre”… ¡Esa es la verdadera esencia de la ciencia! En lugar de solo memorizar la palabra “electrólisis”, experimentar cómo una sustancia se transforma, cómo desaparece un color y cómo nace un material nuevo justo frente a ti, profundiza inmensamente la fascinación por la química. ¡Es un experimento realmente fascinante, lleno de descubrimientos! Incluso compré este libro sobre experimentos a microescala.
Contacto y Solicitudes
¡Acerca los misterios y la diversión de la ciencia! Aquí te resumimos de forma sencilla experimentos científicos divertidos que puedes hacer en casa y sus trucos. ¡Te invitamos a buscar más! ・Sobre el administrador, Ken Kuwako, haz clic aquí ・Para consultas de trabajo (escritura, conferencias, talleres de experimentos, supervisión/apariciones en TV, etc.), haz clic aquí ・¡Las actualizaciones de los artículos se publican en X!
![]() ¡Subimos videos de experimentos en el canal Kagaku no Neta Channel (Canal de Trucos de Ciencia)!
¡Subimos videos de experimentos en el canal Kagaku no Neta Channel (Canal de Trucos de Ciencia)!
3月のイチオシ実験!
- 押し花を作ろう!:梅や桜の花の押し花を作ってみましょう。特別なケースに入れると、長く保存できて、しおりにもなります。
テレビ番組・科学監修等のお知らせ
- 「月曜から夜更かし」(日本テレビ)にて科学監修・出演しました。
- 2月27日放送予定「チコちゃんに叱られる」(NHK)の科学監修しました。
書籍のお知らせ
- 1/27 『見えない力と遊ぼう!電気・磁石・熱の実験』(工学社)を執筆しました。
- サクセス15 2月号にて「浸透圧」に関する科学記事を執筆しました。
- 『大人のための高校物理復習帳』(講談社)…一般向けに日常の物理について公式を元に紐解きました。特設サイトでは実験を多数紹介しています。※増刷がかかり6刷となりました(2026/02/01)

- 『きめる!共通テスト 物理基礎 改訂版』(学研)… 高校物理の参考書です。イラストを多くしてイメージが持てるように描きました。授業についていけない、物理が苦手、そんな生徒におすすめです。特設サイトはこちら。

講師・ショー・その他お知らせ
- 3/20(金) 日本理科教育学会オンライン全国大会2026「慣性の法則の概念形成を目指した探究的な学びの実践」について発表します。B会場 第3セッション: 学習指導・教材(中学校)③ 11:20-12:20
- 7/18(土) 教員向け実験講習会「ナリカカサイエンスアカデミー」の講師をします。お会いしましょう。
- 10/10(土) 秘密兵器「帯電ガン」が炸裂!ビリビリ!ドキドキ!静電気サイエンスショー@千葉市科学フェスタ(午後予定)
- 各種SNS X(Twitter)/instagram/Facebook/BlueSky/Threads
Explore
- 楽しい実験…お子さんと一緒に夢中になれるイチオシの科学実験を多数紹介しています。また、高校物理の理解を深めるための動画教材も用意しました。
- 理科の教材… 理科教師をバックアップ!授業の質を高め、準備を効率化するための選りすぐりの教材を紹介しています。
- Youtube…科学実験等の動画を配信しています。
- 科学ラジオ …科学トピックをほぼ毎日配信中!AI技術を駆使して作成した「耳で楽しむ科学」をお届けします。
- 講演 …全国各地で実験講習会・サイエンスショー等を行っています。
- About …「科学のネタ帳」のコンセプトや、運営者である桑子研のプロフィール・想いをまとめています。
- お問い合わせ …実験教室のご依頼、執筆・講演の相談、科学監修等はこちらのフォームからお寄せください。

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c4b1d07.ce019e28.2c4b1d08.6132124d/?me_id=1208593&item_id=10346879&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Farde%2Fcabinet%2Fitem654%2F5312487_1.jpg%3F_ex%3D240x240&s=240x240&t=picttext)